Без рубрики
Fonctions et application des mucines d’escargot
Les mucines sont une famille de protéines hautement glycosylées qui sont sécrétées par les animaux pour l’adhésion, hydratation, lubrification, et autres fonctions. Malgré leur omniprésence, les mucines animales sont en grande partie non caractérisées. Les escargots produisent des protéines de mucine dans leur mucus pour un large éventail de fonctions biologiques, y compris la protection microbienne, adhérence et lubrification. Récemment, Les mucines d’escargot sont également devenues une source lucrative d’innovation avec un large éventail d’applications dans la chimie, biologie, biotechnologie, et la biomédecine. Spécifiquement, les mucuses d’escargot ont été appliqués comme produits de soins de la peau, agents cicatrisants, colles chirurgicales, et pour lutter contre les ulcères gastriques. Progrès récents en matière d’omique intégrée (génomique, transcriptomique, protéomique, glycomique) les technologies ont amélioré la caractérisation des mucines gastéropodes, accroître la production de nouveaux biomatériaux. Cette perspective décrit les recherches actuelles sur le mucus d’escargot sécrété, mettre en évidence le potentiel de ce biopolymère, et décrit également une stratégie de recherche pour répondre au besoin non satisfait d’examiner les structures hiérarchiques qui conduisent à l’énorme diversité biologique et chimique des gènes du mucus d’escargot.
Introduction
L’intrigue dans les traînées de boue de mucus laissées par les escargots et les limaces remonte à la Grèce antique, où ils ont utilisé le mucus pour sa capacité à réduire l’inflammation et les signes du vieillissement. Aujourd’hui, le mucus d’escargot est toujours utilisé dans les produits de soins de la peau par diverses entreprises et constitue un marché en croissance dont la valeur devrait approcher $770 millions par 2025. Malgré ses applications commerciales, le domaine de la recherche sur le mucus reste étonnamment sous-développé. Le principal constituant responsable des propriétés du mucus sont les mucines sécrétées, une famille de protéines fortement glycosylées produites dans les cellules épithéliales chez la plupart des animaux. Les mucines sont soit liées à la membrane plasmique, soit sécrétées par la cellule, et chaque type présente des différences majeures dans ses fonctions et ses capacités. Les mucines liées à la membrane sont des glycolipides qui agissent comme des marqueurs pour la signalisation cellulaire et protègent également la cellule contre les affronts extracellulaires qui pourraient entraîner des dommages., comme les infections et les tensions physiques . Les mucines sécrétées peuvent être des biopolymères gélatineuses ou non gélifiantes. Les biopolymères sécrétés forment les muqueuses à l’échelle macroscopique. Ces membranes muqueuses représentent une grande partie de la surface des organismes multicellulaires exposés à l’environnement. Chez l’homme, les membranes muqueuses sont responsables 99% de la surface des corps. Chaque espèce d’escargot sécrète plusieurs mucus fonctionnels distincts. Le mucus produit par un pied d’escargot est utilisé pour l’adhérence et la lubrification, permettant à l’escargot de coller ou de marcher sur n’importe quelle surface, même lorsqu’il est inversé. De plus, le mucus produit sur le dos de l’escargot est utilisé pour la défense microbienne et l’hydratation des tissus. Certaines espèces d’escargots ont des utilisations spécialisées pour le mucus. Par exemple, Falsilunatia eltanini (Escargot de Lune) utilise du mucus pour protéger leurs œufs, et Tikoconus costarricanus (Escargot terrestre du Costa Rica), utilise du mucus pour les activités portantes, comme se cacher du Soleil au fond des feuilles pendant les sécheresses. Progrès récents en omique (génomique, transcriptomique, protéomique, glycomique) les technologies ont élargi l’exploration des mucines gastéropodes en tant que ressource scientifique avec de vastes applications dans la chimie, biologie, biotechnologie, et la médecine. Par exemple, les propriétés antimicrobiennes du mucus d’escargot sont utilisées pour lutter contre les troubles observés chez l’homme, allant des ulcères gastriques, aux infections post-chirurgicales. Les mucines sont également associées à des thérapies approuvées afin de potentialiser les capacités du médicament à guérir les maladies., comme le diabète et la colite ulcéreuse. De plus, Les mucines d’escargot sont étudiées dans un large éventail d’autres applications biotechniques qui exploitent leurs propriétés tensioactives . Malgré leur potentiel, On sait peu de choses sur la façon dont les structures hiérarchiques de la mucine expliquent leurs diverses propriétés fonctionnelles. Il existe un besoin non satisfait d’examiner la diversité biologique et chimique des gènes de la mucine d’escargot pour élucider les principes directeurs qui déterminent les diverses propriétés associées à chaque gène.. Cet article de perspective mettra en évidence les applications actuelles du mucus d’escargot sécrété qui démontrent le potentiel de ce biopolymère en tant que ressource pour les progrès biotechnologiques et biomédicaux. Nous décrirons également une stratégie omique intégrée pour étudier la diversité biologique et chimique des gènes du mucus d’escargot.
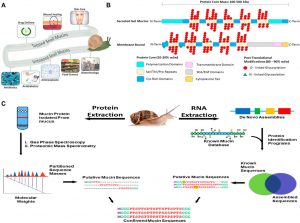
(Un) Applications du mucus d’escargot. Le mucus d’escargot a été utilisé pour les soins de la peau, cicatrisation et rajeunissement des plaies, et l’administration de médicaments. Le mucus d’escargot est exploré dans la science alimentaire, revêtements d’implants, et d’autres secteurs biotechniques font actuellement des recherches sur les mucines à explorer pour une utilisation potentielle. (B) Une représentation en 2 dimensions des structures de mucine. Les mucines sont caractérisées par deux parties de leur structure, leur noyau protéique, et leur ramification glycane. Le noyau protéique est une séquence protéique de longueur variable en fonction du gène de la mucine, qui a été modifié avec des branches de glycosylation. La structure des protéines, cependant a plusieurs domaines, et ces domaines varient en fonction de la fonction et de l’emplacement cellulaire de la mucine. Les branches de glycane sont des branches de sucre allant de 3 À 18 sucres, et constituent la majorité de la masse de mucine. Sont affichés 2 représentations dimensionnelles des différents types de mucines, et leurs caractéristiques stéréotypées. (C) Application d’une approche omique intégrée pour identifier la séquence de mucine d’escargot, structure, et fonction. Chemin 1(Gauche) extraire des protéines de mucine brutes et les séparer des débris cellulaires pour obtenir des masses séquentielles à partir d’analyses spectroscopiques et spectrométriques de masse. Chemin 2(Droite) Extraction de l’ARN des glandes muqueuses ou d’un animal entier suivie de de novo assemblage de séquences de gènes de mucine pour générer une base de données à BLAST par comparaison de séquences assemblées à une base de données de mucine connue, on obtient des séquences de mucine putative. En combinant les pipelines protéomique et ARN, nous confirmons la séquence de mucine de type natif pour une analyse plus approfondie..
Variations structurelles des mucines
Les mucines contiennent plusieurs domaines qui contribuent à leur fonction globale. La variation structurelle permet leur grande diversité biologique et leurs caractéristiques physiques uniques. Domaine de répétition en tandem situé au centre de l’épine dorsale protéique, riche en sérine, thréonine, et proline, sert d’ancrage pour la glycosylation. Les glycanes de mucine sont principalement liés à l’O, mais des quantités mineures de glycanes liés à l’azote peuvent être présentes. La longueur du domaine de glycosylation et le nombre de répétitions diffèrent entre les mucines et confèrent des caractéristiques chimiques différentes. Les mucines sécrétées ont des régions riches en cystéine aux deux extrémités du domaine de répétition en tandem qui sont utilisées pour la stabilisation, fournir des points de pont disulfure pour les deux inter- et liaison intramoléculaire. De plus, ces régions servent à la fois à fournir une diversification structurelle supplémentaire, et permettre la multimérisation des mucines et autres biomolécules riches en soufre .
Typiquement, N-acétylgalactosamine (GalNAc) est attaché au noyau protéique par des liaisons O-glycosidiques entre le monosaccharide et les résidus Ser ou Thr (GalNAc[α1]-Ser/Thr). Cela forme l’antigène TN, qui est couramment trouvé chez l’homme pour être régulé à la hausse dans certains cancers . De là, le galactose est ajouté à la structure (Gal[β1-3]GalNAc[α1]-Ser/Thr), formant le noyau de mucine 1 O-glycane. Les O-glycanes varient en taille, De 2 À 20 résidus de sucre, et dans la composition, comme d’autres sucres tels que la N-acétylglucosamine (GlcNAc) et fucose (Fuc) sont ajoutés séquentiellement. Les acides sialiques et le mannose se trouvent également à l’état de traces. Acides sialiques en particulier, ont été connus pour jouer un rôle majeur dans les propriétés immunitaires des mucines. L’acide sialique médie les interactions de cellule à cellule, en plus d’être capable de masquer les antigènes des macrophages humains . Plus loin, Les acides sialiques sont les principaux points de liaison des lectines, une famille de protéines commune trouvée dans le système immunitaire inné. De plus, les mucines sécrétées présentent également une C-mannosylation, où C1 du mannose se lie à l’anneau indole dans le tryptophane, permettant une plus grande variation de la structure tertiaire .
Changements subtils dans la structure de la mucine, en particulier la séquence d’acides aminés et la glycosylation, peut correspondre à une fonction biologique très différente . Alors que ces protéines sont principalement des glucides en poids, jusqu’à 90%, les structures protéiques et glycanes fournissent des caractéristiques fonctionnelles globales à la mucine. De plus, les mucines individuelles peuvent avoir plusieurs glycoformes dans des états normaux et malades, et différentes populations d’une même espèce peuvent présenter des glycoformes distinctes. Cette diversité permet aux organismes d’individualiser chaque mucine pour des conditions physiologiques et environnementales spécifiques. Dans l’ensemble, on sait peu de choses sur la connexion génotype-phénotype des gènes de la mucine qui conduit aux diverses propriétés fonctionnelles. Plusieurs gènes de mucine humaine ont été identifiés et il y a au moins 21 gènes codant pour la mucine validés, chacun ayant des activités biologiques différentes. En revanche, alors que de nombreux gènes putatifs de mucine d’escargot ont été identifiés, aucun n’a été validé. Toutefois, l’absence de caractérisation robuste de la génétique et des différences structurelles entre les mucuses d’escargot n’a pas empêché leur application pour répondre aux besoins urgents en matériaux médicaux et biotechnologiques.
Mucines d’escargot comme agents antimicrobiens
Les bactéries résistantes aux antibiotiques deviennent un problème de plus en plus répandu sans de nombreuses solutions viables. Parce que les mollusques manquent d’immunité adaptative, ils dépendent de barrières physiques et d’une immunité innée pour la protection contre les agents pathogènes. Pour la plupart des escargots, le pied est le plus en contact avec les surfaces contaminées par des agents pathogènes et des parasites, et la sécrétion de mucus le long des pieds protège contre de tels microbes. L’une des premières mucuses évaluées pour l’activité antimicrobienne a été celle de Achatina fulica (Escargot terrestre géant africain). Mucus de Un. fulica a démontré une activité antibactérienne prometteuse contre les bactéries à Gram positif, Bacillus subtilis et Staphylococcus aureus, et les bactéries à Gram négatif, Escherichia coli et Pseudomonas aeruginosa . Les sécrétions de mucus de Un. fulica a inhibé la croissance bactérienne des deux S. Aureus et S. épidermidis lorsqu’il est appliqué via des films de pansement sur un modèle murin. Les pansements ont amélioré la maturation du tissu de granulation et le taux de dépôt de collagène, qui sont connus pour accélérer le processus de guérison . Dans une étude similaire, le mucus de Helix aspersa activité antimicrobienne démontrée contre plusieurs souches de Pseudomonas aeruginosa. Plus loin, le mucus des deux Un. marginata et Un. fulica, ont été utilisés comme pansements 28 échantillons cliniques de plaies prélevés avec des infections courantes connues. Le mucus a montré une puissance antibactérienne contre Staphylocoque, Streptocoque, et Pseudomonas isolé des plaies. Dans la même étude, par rapport à sept antibiotiques courants, y compris l’amoxicilline, streptomycine, et chloramphénicol, certaines des sécrétions de mucus étaient plus inhibitrices des infections que les antibiotiques commerciaux. Comprendre les propriétés antimicrobiennes du mucus d’escargot est un domaine de recherche actif et en pleine croissance.
Espèces de mollusques dont la mucine a été appliquée dans divers secteurs pour des applications biomédicales ou biotechnologiques. Molluscan mucin appliqué comme antimicrobien pour inhiber les agents pathogènes.
Les mucines d’escargots comme véhicules d’administration de médicaments
L’adaptabilité des biopolymères de mucine d’escargot en fait des candidats particulièrement prometteurs pour de nouveaux systèmes d’administration de médicaments. Pendant l’accouplement, les escargots mâles tirent une fléchette pour délivrer du mucus contenant des protéines accessoires à la femelle, ce qui à son tour augmente la fertilité de l’escargot femelle . Ce processus repose sur un système multifonctionnel, chaque composant jouant un rôle défini. La fléchette agit comme une aiguille, percer le tissu et injecter le mucus qui transporte les protéines accessoires dans l’escargot femelle. De la même manière, le mucus pourrait être adapté pour agir comme vecteur d’administration de molécules bioactives. Le mucus d’escargot est connu pour se marier exceptionnellement bien avec tout médicament absorbé par les muqueuses en raison de sa capacité à faciliter la diffusion à travers les membranes . Par exemple, chlorhydrate de metformine, un médicament contre le diabète, a été attaché à la mucine de l’escargot terrestre africain géant à l’aide de polyéthylène glycol (CHEVILLE) pour augmenter la biodisponibilité du médicament. PEGylation, est un procédé couramment utilisé où un traitement est entouré d’une matrice de polymères principalement, polyéthylène glycol. Cette matrice affecte avantageusement la pharmacocinétique de la thérapeutique, prolongation de la demi-vie, via la protection contre les anticorps, et permettant un contrôle variable de la biodistribution en fonction de la composition de la matrice. La mucine d’escargot en particulier est prometteuse en tant que polymère, car ils sont très hydrophiles, et interagissent également facilement avec les muqueuses gastro-intestinales, un emplacement commun d’absorption des médicaments. La PEGylated-mucine chargée de metformine a amélioré la pharmacocinétique et la pharmacodynamique du médicament normalement mal absorbé, augmentation de la libération à 92% par rapport à l' 81% actuellement utilisé sur le marché. Dans une autre application, entier Costus afer (lys gingembre) fleurs combinées avec du mucus d’escargot ont montré une réduction de la glycémie chez les diabétiques Mus musculus (Souris albinos suisses) de manière dose-dépendante, qui a montré le potentiel antidiabétique possible de la mucine d’escargot.
La matrice polymère liant les médicaments et les cristaux de vatérite contenant de la mucine ont été utilisés comme vecteurs d’administration de médicaments pour le chargement efficace et la libération contrôlée de petits médicaments anticancéreux et de thérapies à base de protéines. Microcristaux de vatérite, lorsqu’il est cristallisé dans des concentrations de mucine comprises entre 1 et 6 mg/ml, avoir une meilleure rétention des bioactivités cationiques et une meilleure stabilité dans des conditions physiologiques En outre, les mucines ont été associées à des photosensibilisants afin d’améliorer le ciblage et d’optimiser le contrôle de l’administration dans les cellules cancéreuses. Les capsules multicouches de mucine auto-assemblées et les microparticules contenant de la mucine présentent un intérêt particulier pour les études futures sur les mécanismes d’administration de médicaments à libération contrôlée, en particulier pour surmonter les défis de la biocompatibilité, biodégradabilité, et mucoadhérence.
Mucines d’escargot comme agents anti-tumoraux
La mucine d’escargot a montré un potentiel thérapeutique contre le mélanome, l’un des cancers de la peau les plus dangereux. Alors que les nouveaux développements dans le traitement du cancer ont entraîné des taux de rémission plus élevés et une espérance de vie plus longue pour les personnes atteintes, ces développements n’ont pas montré de rendements similaires pour le mélanome. Comme la résistance au traitement est fréquente pour ce cancer, il est urgent de trouver de nouvelles approches efficaces pour traiter le mélanome. Une étude de H. apersa le mucus sur les lignées cellulaires de mélanome a rapporté que le mucus d’escargot diminuait la viabilité et inhibait les métastases des cellules de mélanome. La diminution de la viabilité des cellules a été attribuée à un événement apoptotique lié au clivage du Poly (ADP-ribose) polymérase (Le). De plus, l’inhibition des métastases a été obtenue en bloquant la fonction et l’expression de l’intégrine, et empêchant ainsi le cancer de se développer. Dans une autre étude, H. aspersa la mucine a directement inhibé la croissance de deux lignées cellulaires de mélanome humain, en augmentant l’expression de la cytokine TNFα, et inhibant NF-κB, un processus de transcription qui, dans une régulation appropriée, a été lié à la progression du cancer, la croissance de ces lignées cellulaires a diminué, démontrant ses propriétés anti-mélanogènes. Alors qu’il en est encore aux premiers stades de développement, l’application de mucines d’escargot comme agents antitumoraux présente un intérêt croissant dans la communauté biomédicale.
Les mucines d’escargot facilitent la cicatrisation des plaies
Le mucus d’escargot peut faciliter la guérison et est devenu une ressource importante dans la recherche sur les plaies. Mucines de l' Helix aspersa (Escargot de jardin) il a été démontré qu’ils aident à la régénération de la peau après une radiodermatite aiguë, un effet secondaire courant de la radiothérapie. Le mucus d’escargot de jardin aurait augmenté les taux de guérison grâce à la régulation des antioxydants et des radicaux libres. Mucus de l’érythème amélioré du jardin chez les modèles de rats, et, les mêmes rats ont également montré une réduction du photovieillissement. En plus d’être capable de traiter les blessures superficielles, les mucines ont montré la capacité d’être utilisées sur les plaies internes. Les mucines ont été incorporées aux côtés d’anti-inflammatoires oraux non stéroïdiens (AINS), pour réduire ou éliminer les lésions de la muqueuse gastrique. Les AINS réduisent l’inflammation, mais ont des effets secondaires indésirables liés à des lésions gastro-intestinales et à des lésions hépatiques. De nombreuses entreprises se sont tournées vers les produits naturels pour contrer ces effets secondaires, et Mucin ont été montrés pour traiter les ulcères peptiques, a effets secondaires causés par les AINS. Une combinaison de l’antibiotique, clarithromycine, et Un. fulica la mucine a montré des résultats positifs dans le traitement de l’ulcère peptique. En plus des propriétés anti-ulcéreuses, le taux de guérison des ulcères augmentait avec la concentration de mucine et était plus rapide que la clarithromycine seule.
Mucus d’escargot utilisé pour les matériaux bioinspirés
L’étude des substances naturelles en tant que plate-forme pour construire de nouveaux matériaux a abouti à de multiples produits révolutionnaires, comme Lipitor, Pénicilline, et Morphine. De la même façon, les mucines ont été utilisées comme revêtement de biomatériau afin de réduire le rejet des implants inorganiques. Le rejet d’implants chirurgicaux en raison d’une infection entraîne des résultats supérieurs 1 millions de cas médicaux par an, le coût de la chirurgie initiale n’étant qu’une fraction du coût du traitement de l’infection correspondante. Application de films à base de mucine sur le polyéthylène téréphtalate, un matériau couramment utilisé dans les implants médicaux, a considérablement réduit la réponse immunitaire déclenchée par l’absorption des IgG et des IgM dans le plastique. La même étude a également montré qu’il réduisait l’activation du fibrinogène, un agent inflammatoire connu, lors du contact avec le revêtement de mucine par rapport au plastique non revêtu. Il a été démontré dans d’autres études que les mucines réduisent la reproduction des microbes sur les dispositifs implantés. Les technologies à base de mucine sont extrêmement prometteuses pour les progrès dans le domaine des biomatériaux.
Un exemple d’utilisation des mucines comme biomatériaux est l’application des mucines dans la synthèse d’hydrocarbures solubles dans l’eau. En ligaturant la mucine et/ou les composés imitant la mucine avec une chaîne lipidique hydrophobe, le complexe hydrocarboné est resté en suspension dans des conditions aqueuses, même après plusieurs mois, tandis que l’hydrocarbure non complexé précipiterait rapidement de la solution. Dans une autre étude connexe menée par le groupe de Combaa, cette propriété a été appliquée pour améliorer la détection du glucose en créant une suspension stabilisée du complexe nanotube de carbone-mucine pour un biocapteur de glucose de type sandwich. Le dispositif bioanalytique qui en résulte est 20% plus sensibles et 40% plus rapide que les appareils conventionnels qui n’incluent pas cette matrice de conception de capteur.
Mucines, qui entrent en contact avec des médicaments absorbés par les muqueuses, peut également être utilisé en chromatographie pour aider à déterminer la biodisponibilité et l’absorption à travers la membrane. Mucine gastrique porcine, lié à la colonne de silice via des liants aminopropyliques, permis de séparer les molécules du médicament par l’affinité de liaison de la membrane muqueuse du médicament. Dans une autre étude, la mucine a été ancrée à une colonne en utilisant un échange d’ions avec de l’alginate de calcium, la mucine est immobilisée, imiter les muqueuses biologiques. Un temps de rétention plus long de la molécule dans la colonne de mucine indiquait une interaction médicament-mucine élevée, qui est corrélée à une biodisponibilité retardée in vivo. Cela ajoute une autre dimension pour évaluer les médicaments utilisés dans des maladies spécifiques qui affectent la production de mucine, comme la fibrose kystique.
La même colonne de mucine gastrique porcine a été utilisée pour évaluer la rétention de saveur par l’industrie alimentaire. Il a été démontré que la colonne de mucine imitait une langue de bovin pour la rétention de la saveur, ce qui réduit le besoin et pourrait potentiellement éliminer l’expérimentation animale. Les mucines ont été largement étudiées dans leur rôle dans la perception de la saveur. La présence de mucines dans la cavité buccale a été directement corrélée à une sédimentation accrue des composés aromatisants, ce qui à son tour augmente la perception de la saveur. Ce phénomène est également examiné comme la cause de la perte de goût chez les personnes âgées.. Une diminution des niveaux de MUC7 dans la salive a été notée chez les personnes âgées diminution du goût. On pense que cette régulation négative réduit l’adhésion des molécules aromatiques, conduisant à une perception atténuée du goût.
Un rythme d’escargot pour la caractérisation des molécules de mucine
Malgré l’intérêt croissant pour le domaine, il existe encore de nombreux obstacles qui empêchent les progrès de la recherche sur la mucine d’escargot. De nombreuses espèces d’escargots qui ont le potentiel de découvrir de nouvelles mucines sont souvent inaccessibles en raison de leur habitat. Le manque d’échantillons de matériel biologique facilement accessibles et la difficulté d’identifier les structures de mucine empêchent la synthèse fiable des mucines en quantités suffisantes pour des expériences répétées. Plusieurs groupes étudient la durabilité, approches évolutives pour la production de mucines synthétiques, cependant le champ en est à ses balbutiements Alors que les mucines qui ont été isolées de la Un. fulica ont fait l’objet d’études approfondies, d’autres espèces restent négligées.
La méthode la plus viable pour la production commerciale de mucine reste l’extraction et l’isolement des animaux, qui ne permet pas de rendements substantiels pour une application sans capital animal abondant et implique généralement des méthodes invasives. La complexité, abondance, et localisation des schémas de glycosylation sur chaque mucine, en plus de divers glycoformes de mucine causent des difficultés à utiliser des méthodes de séparation courantes pour purifier, synthétiser, et analyser des échantillons de mucine. Les mucines subissent souvent des modifications post-traductionnelles, comme l’O-sulfatation, N-sulfatation, et la N-désacétylation qui différencie la fonction entre les protéines. Ces modifications post-traductionnelles du glycane sont un obstacle à la purification des échantillons de mucine, caractérisation, et synthèse. Une approche synthétique prometteuse consiste à utiliser des bactéries recombinantes, glycosyltransférase(GT)-polymérisation médiée, et trans-glycosylation. Toutefois, ces méthodes sont insuffisantes pour obtenir des rendements pratiques sur le plan industriel et ne parviendront pas à générer l’ensemble exhaustif de glycoformes qui comprennent les gels naturels de mucus. Il est encore difficile de créer le O–glycosylation dans la levure, et il y a des défis à relever dans le transfert des branches de glycosylation aux résidus de protéines choisis. Ces questions présentent un besoin de développer des méthodes viables et à haut rendement pour synthétiser les mucines à l’aide de chimies évolutives, ce qui serait la première étape dans l’utilisation des mucines comme thérapies ou traitements ciblés.
Ces dernières années ont vu l’émergence de technologies -omiques (génomique, transcriptomique, protéomique, glycomique) qui nécessitent des quantités minimales d’échantillons, permettant la caractérisation d’échantillons d’escargots rares ou peu accessibles. Une stratégie similaire à ce qui a été fait avec les venins d’escargot en utilisant la vénomics, qui associe des méthodes transcriptomiques et protéomiques avec de novo séquencer des programmes d’assemblage bioinformatique pour identifier la structure génétique des toxines peptidiques putatives du venin d’escargot, peut être appliqué pour caractériser les gènes de la mucine et les protéines de mucus. Spécifiquement, en prenant les séquences nucléotidiques des exomes assemblés, puis en l’associant à des valeurs de masse protéomiques, nous pouvons confirmer les structures protéiques linéaires de la mucine. Dans cette approche, nous extrayons l’ARNm des glandes muqueuses ou de l’animal entier et par le biais d’un pipeline bioinformatique, identifier les gènes de la mucine et les séquences de protéines de mucine primaires. Une nouvelle initiative, le projet Comparative Animal Mucomics (CAMP) appliquera une analyse comparative systématique des gènes de la mucine et des hydrogels de mucus pour déterminer les structures hiérarchiques et les propriétés des mucus distincts.
Malgré la promesse de méthodes omiques pour produire des bases de données robustes de mucines, des obstacles majeurs subsistent encore pour leur étude. L’un de ces obstacles sont les algorithmes utilisés pour assembler des gènes séquencés. Graphes de De Bruijn, quelle est la séquence d’algorithmes utilisée par la plupart des assembleurs, avoir de la difficulté à cartographier les domaines répétés en raison de la multiplicité de séquences similaires qui se chevauchent. Plusieurs outils sont en cours de développement pour surmonter ce problème . Chaque programme modifie la pondération des k-mers qui sont utilisés pour construire les graphes de De Bruijn afin de s’adapter aux répétitions en tandem. Pour l’étude protéomique de la mucine, les interactions intermoléculaires des mucines avec d’autres mucines provoquent un degré de difficulté supplémentaire. Les mucines créeront naturellement des multimères d’eux-mêmes, connecter plusieurs protéines ensemble afin de former une structure plus grande, qui est régulièrement observé dans la nature. Afin d’obtenir ensuite une seule protéine, les liaisons jointes doivent être rompues, sans rompre également les liaisons de la protéine unique. Toutefois, Les liaisons multimères de mucine sont difficiles à réduire sans avoir également un effet sur le reste de la structure secondaire d’une seule chaîne de mucine. Une procédure d’essai et d’erreur est actuellement utilisée dans les études protéomiques de la mucine pour générer des masses protéiques uniques. De nouvelles techniques de caractérisation et de synthèse devront être établies pour identifier et fabriquer avec précision les mucines d’escargot, et avec une approche omique, nous pourrions être en mesure de déterminer le génotype à la cartographie du phénotype nécessaire pour comprendre et déchiffrer les différences de fonctionnalité trouvées dans chaque échantillon de mucine.
Remarques finales et perspectives d’avenir
Les escargots se trouvent dans presque tous les biomes, et les conditions environnementales semblent conduire à la diversité des gènes de la mucine et à la polyvalence des fonctions du mucus. Les mucines d’escargot ont démontré un potentiel biomédical et biotechnologique, et sont une ressource bioinspirée et très prometteuse. La caractérisation des mucines d’escargot n’est pas limitée par leur valeur intrinsèque, mais par l’accès et la complexité de l’identification de la molécule, purification et investigation. Il reste encore plusieurs questions à répondre sur les propriétés des mucines et des mucuses par rapport aux utilisations applicables.. Cette perspective démontre le potentiel de rendement élevé des mucines d’escargot, et en utilisant un pipeline omique comparatif adaptable, nous pouvons mieux comprendre ces protéines uniques, et leurs propriétés biologiques et chimiques avantageuses.
Références: Abdulla, Un., Adams, N., Os, M., Elliott, Un. M., Gaffin, J., Jones, D., et coll.. (2013). Conseils sur la prise en charge de la douleur chez les personnes âgées. Vieillissement en âge 42, i1 à i57. Doi:10.1093/vieillissement/afs200
Abdallah, L. H., Coakley, R., Webster, M. J., Zhu, Y., Tarran, R., Radicioni, G., et coll.. (2018). Production de mucine et réponses d’hydratation aux matériaux mucopurulents dans l’épithélium des voies respiratoires normales par rapport à la fibrose kystique. Suis. J. Respirer. Crit. Soins Med. 197, 481–491. Doi:10.1164/rccm.201706-1139oc
guchi, S. M. M., Aikawa, T., et Matsumoto, J. J. (1982). Activité antibactérienne de la mucine de mucus d’escargot. Comp. Biochimie. Physiol. Un: Physiol. 72, 571–574. Doi:10.1016/0300-9629(82)90123-2
Lodi, M., Staikou, Un., Janssen, R., et Koene, J. M. (2017). Un niveau élevé de compétition de spermatozoïdes peut augmenter le transfert de produits accessoires pour les glandes transportés par la fléchette d’amour des escargots terrestres. Ecol. Evol. 7, 11148–11156. Doi:10.1002/ece3.3385
Maman, J., Rubin, B. K., et Voynow, J. Un. (2018). Mucines, Mucus, et cellules de gobelet. Poitrine 154, 169–176. Doi:10.1016/j.chest.2017.11.008
Martins, M. D. F., Caetano, F. Un. M., Sírio, O. J., Yiomasa, M. M., Mizusaki, C. Je., et Figueiredo, L. D. (2003). Avaliação macro e microscópica da cicatrização de lesões experimentalmente provocadas em pele de coelhos tratadas com secreção mucoglicoproteica Do escargot Achatina fulica. Braz. J. Vétérinaire. Res. Anim. Sci. 40, 213. Doi:10.1590/s1413-95962003000900009
Un. Michel (Éditeur) (2012). « Potentiels multiples des biopolymères d’origine animale tropicale dans l’administration de médicaments: Leçons de la mucine d’escargot africaine," Biopolymères dans l’administration de médicaments: Avancées et défis récents (Sharjah, Eau: BENTHAM SCIENCE PUBLISHERS), 27–38. Doi:10.2174/978160805078910901010027
Mikheenko, Un., Bzikadze, Un. V., Gourevitch, Un., Miga, K. H., et Pevzner, P. Un. (2020). TandemTools: Mappage des lectures longues et évaluation/amélioration de la qualité de l’assemblage dans les répétitions tandem extra-longues. Mars. Drogues 17, i75 à i83. Doi:10.1093/bioinformatique/btaa440
Momoh, M. Un., Akpa, P. Un., Ugwu, K. C., Kenechukwu, F. C., et Kenneth, O. C. (2020). Comportement pharmacodynamique et pharmacocinétique de l’insuline à partir de microparticules de PEGylated-Mucin recouvertes d’un polymère sensible au pH: Préparation et caractérisation. Mater. Aujourd’hui Commun. 25, 101539. Doi:10.1016/j.mtcomm.2020.101539
Momoh, M., Adedokun, M., Adikwu, M., et Ibezim, C. (2014). In vitro évaluation de la matrice PEGylated-Mucin comme vecteur pour l’administration orale de chlorhydrate de metformine. Le Trop. J. Pharm. Res. 13, 1039–1045. Doi:10.4314/tjpr.v13i7.5
Mu, Un., Okolie, C. O., et Agboke, Un. (2008). L’effet de la mucine d’escargot sur le taux de guérison des ulcères de la clarithromycine. J. Pharm. Res. 8, 6. Doi:10.18579/jpcrkc/2009/8/1/79523
Mumuni, M. Un., Kenechukwu, F. C., Ofokansi, K. C., Attama, Un. Un., et Díaz, D. D. (2020). Nanoparticules muco-adhésives chargées d’insuline à base de complexes mucine-chitosane pour l’administration orale et le traitement du diabète. Carbohydr. Polym. 229, 115506. Doi:10.1016/j.carbpol.2019.115506
Navarro, L. Un., Français, D. L., et Zauscher, S. (2018). Progrès dans la synthèse de l’imitation de la mucine et les applications en science des surfaces. Curr. Opin. Colloïde Interf. Sci. 38, 122–134. Doi:10.1016/j.cocis.2018.09.004
Nguyen, J. K., Masub, N., et Jagdeo, J. (2020). Ingrédients bioactifs dans les cosméceutiques coréens: Tendances et données probantes de la recherche. J. Cosmet. Dermatol. 19, 1555–1569. Doi:10.1111/jocd.13344
Parc, Y. (2011). Extraction de produits naturels d’invertébrés pour un futur trésor thérapeutique. Nat. Aiguillonner. Commun. 6 (9), 1403–1408. Doi:10.1177/1934578×1100600944
Perez-Vilar, J., et Hill, R. L. (1999). La structure et l’assemblage des mucines sécrétées. J. Biol. Chem. 274, 31751–31754. Doi:10.1074/jbc.274.45.31751
Petrou, G., et Crouzier, T. (2018). Les mucines en tant que blocs de construction multifonctionnels des biomatériaux. Biomater. Sci. 6, 2282–2297. Doi:10.1039/c8bm0047
Pitt, S. J., Graham, M. Un., Dedi, C. G., Taylor-Harris, P. M., et Gunn, Un. (2015). Propriétés antimicrobiennes du mucus de l’escargot de jardin brun Helix Aspersa. Br. J. Biomed. Sci. 72, 174–181. Doi:10.1080/09674845.2015.11665749
Premi, S. (2020). Rôle de la chemiexcitation de la mélanine dans la progression du mélanome et la résistance aux médicaments. Devant. Oncol. 10. Doi:10.3389/fonc.2020.01305
Pushpass, R.-A. G., Pellicciotta, N., Kelly, C., Proctor, G., et Charpentier, G. H. (2019). La réduction de la liaison à la mucine salivaire et de la glycosylation chez les personnes âgées influence le goût dans un In vitro Modèle de cellule. Nutriments 11, 2280. Doi:10.3390/nu11102280
Pushpass, R. G., Daly, B., Kelly, C., Proctor, G., et Charpentier, G. H. (2019). Altération du flux salivaire, Composition des protéines, et rhéologie après stimulation du goût et du TRP chez les personnes âgées. Devant. Physiol. 10, 652. Doi:10.3389/fphys.2019.00652
Rose, M. C., et Voynow, J. Un. (2006). Gènes de mucine des voies respiratoires et glycoprotéines de mucine dans la santé et la maladie. Physiol. Rev. 86, 245–278. Doi:10.1152/physrev.00010.2005
Rutkowski, P., et Kozak, K. (2017). Nouvelles des sessions sur le mélanome du Congrès européen sur le cancer 2017. BMC Med. 15, 57. Doi:10.1186/s12916-017-0826-4
Sandberg, T., Karlsson Ott, M., Carlsson (en anglais seulement), J., Feiler, Un., et Caldwell, K. D. (2009). Utilisation potentielle des mucines comme revêtements de biomatériaux. Ii. Les revêtements de mucine affectent les propriétés de conformation et d’activation des neutrophiles des protéines hôtes adsorbées - vers une imitation muqueuse. J. Biomed. Mater. Res. 91Un, 773–785. Doi:10.1002/jbm.a.32315
Santana, W. Un., Mélo, C. M. d., Cardoso, J. C., Pereira-Filho, R. N., Rabelo, Un. S., Reis, F. P., et coll.. (2012). Évaluation de l’activité antimicrobienne et du potentiel de guérison de la sécrétion muqueuse de Achatina fulica. Int. J. Morphol. 30, 365–373. Doi:10.4067/s0717-95022012000200001
Sompayrac, L. M. (2012). Comment fonctionne le système immunitaire. 4th Editio.
Van Putten, J. P. M., et Strijbis, K. (2017). Mucines transmembranaires: Récepteurs de signalisation à l’intersection de l’inflammation et du cancer. J. Immunité innée. 9, 281–299. Doi:10.1159/000453594
Fourgon, H., Hjorth, M., Winkeljann, B., Dobryden, Je., Lieleg, O., et Crouzier, T. (2020). Glyco-modification des hydrogels de mucine pour étudier leur activité immunitaire. Application ACS. Mater. Inhumer. 12, 19324–19336. Doi:10.1021/acsami.0c03645
Les auteurs: Maxwell McDermott, Antonio R. Cerullo, James Parziale, Eleonora Achrak, Sharmin Sultana,Jennifer Ferd, Safiyah Samad, William Deng, Adam B. Braunschweig, Mandë Holford.