Subtotal: 3,180.00 €
No encabezado
Funciones y aplicación de Snail Mucins
Las mucinas son una familia de proteínas altamente glicosiladas que son secretadas por los animales para la adhesión., hidratación, lubricación, y otras funciones. A pesar de su ubicuidad, Las mucinas animales son en gran parte no caracterizadas. Los caracoles producen proteínas de mucina en su mucosa para una amplia gama de funciones biológicas, incluida la protección microbiana, adhesión y lubricación. Recientemente, Las mucinas de caracol también se han convertido en una fuente lucrativa de innovación con una amplia gama de aplicaciones en toda la química., biología, biotecnología, y biomedicina. Específicamente, Los mocos de caracol se han aplicado como productos para el cuidado de la piel, agentes cicatrizantes de heridas, pegamentos quirúrgicos, y para combatir las úlceras gástricas. Avances recientes en ómica integrada (genómico, transcriptómica, proteómica, glucómica) Las tecnologías han mejorado la caracterización de las mucinas gasterópodas, aumentar la generación de nuevos biomateriales. Esta perspectiva describe la investigación actual sobre el moco de caracol secretado, destacando el potencial de este biopolímero, y también esboza una estrategia de investigación para satisfacer la necesidad insatisfecha de examinar las estructuras jerárquicas que conducen a la enorme diversidad biológica y química de los genes del moco del caracol..
Introducción
La intriga en los rastros de limo mucoso dejados por caracoles y se remonta a la antigua Grecia, donde utilizaron el moco por su capacidad para reducir la inflamación y los signos del envejecimiento. Hoy en día, el moco de caracol todavía se utiliza en productos para el cuidado de la piel por varias compañías y es un mercado en crecimiento cuyo valor se espera que se acerque. $770 millones por 2025. A pesar de sus aplicaciones comerciales, el campo de la investigación del moco sigue siendo sorprendentemente subdesarrollado. El componente primario que es responsable de las propiedades del moco son las mucinas secretadas., una familia de proteínas fuertemente glicosiladas producidas en las células epiteliales en la mayoría de los animales. Las mucinas se unen a la membrana plasmática o se secretan fuera de la célula, y cada tipo tiene grandes diferencias en sus funciones y capacidades. Las mucinas unidas a la membrana son glicolípidos que actúan como marcadores para la señalización celular y también protegen a la célula de las afrentas extracelulares que podrían provocar daños., como infecciones y tensión física . Las mucinas secretadas pueden ser biopolímeros formadores de gel o no formadores de gel. Los biopolímeros secretados forman membranas mucosas a escala macroscópica. Estas membranas mucosas representan una gran parte de la superficie de los organismos multicelulares expuestos al medio ambiente.. En humanos, las membranas mucosas representan 99% de la superficie de los cuerpos. Cada especie de caracol secreta múltiples mocos funcionales distintos. El moco producido por la pata de caracol se utiliza para la adhesión y para la lubricación, permitir que el caracol se pegue o camine a través de cualquier superficie, incluso cuando está invertido. Adicionalmente, el moco producido en la parte posterior del caracol se utiliza para la defensa microbiana y la hidratación de los tejidos. Ciertas especies de caracoles tienen usos especializados para el moco. Por ejemplo, Falsilunatia eltanini (Caracol Luna) utiliza moco para proteger sus huevos, y Tikoconus costarricanus (Caracol terrestre costarricense), utiliza moco para actividades de carga, tal como esconderse del Sol en el fondo de las hojas durante las sequías. Avances recientes en ómica (genómico, transcriptómica, proteómica, glucómica) Las tecnologías han ampliado la exploración de las mucinas gasterópodas como un recurso científico con una amplia gama de aplicaciones en toda la química., biología, biotecnología, y medicina. Por ejemplo, Las propiedades antimicrobianas del moco de caracol se están utilizando para combatir los trastornos observados en los seres humanos que van desde úlceras gástricas, a infecciones relacionadas con la cirugía postquirúrgica. Las mucinas también se están combinando con terapias aprobadas para potenciar las capacidades del medicamento para curar enfermedades., como diabetes y colitis ulcerosa. Adicionalmente, Las mucinas de caracol están siendo investigadas en una amplia gama de otras aplicaciones biotécnicas que explotan sus propiedades similares a los surfactantes. . A pesar de su potencial, Poco se sabe acerca de cómo las estructuras jerárquicas de mucina explican sus diversas propiedades funcionales. Existe una necesidad insatisfecha de examinar la diversidad biológica y química de los genes de la mucina de caracol para dilucidar los principios rectores que determinan las diversas propiedades asociadas con cada gen.. Este artículo de perspectiva destacará las aplicaciones actuales del moco de caracol secretado que demuestran el potencial de este biopolímero como recurso para los avances biotecnológicos y biomédicos.. También describiremos una estrategia ómica integrada para investigar la diversidad biológica y química de los genes del moco del caracol..
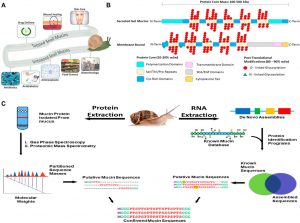
(Un) Aplicaciones de moco de caracol. El moco de caracol se ha utilizado para el cuidado de la piel, cicatrización y rejuvenecimiento de heridas, y la administración de medicamentos. El moco de caracol está siendo explorado en la ciencia de los alimentos, recubrimientos de implantes, y otros sectores biotécnicos están investigando actualmente mucinas para ser exploradas para su uso potencial.. (B) Una representación en 2 dimensiones de las estructuras de mucina. Las mucinas se caracterizan por dos partes de su estructura, su núcleo proteico, y su ramificación de glicanos. El núcleo de proteína es una secuencia de proteínas de longitud variable dependiendo del gen de la mucina., que ha sido modificado aún más con ramas de glicosilación. La estructura de la proteína, Sin embargo, tiene varios dominios, y estos dominios varían dependiendo de la función y la ubicación celular de la mucina. Las ramas de glicano son ramas de azúcar que van desde 3 Para 18 azucares, y constituyen la mayoría de la masa de mucina. Se muestran 2 representaciones dimensionales de los diferentes tipos de mucinas, y sus características estereotipadas. (C) Aplicación de un enfoque ómico integrado para identificar la secuencia de mucina de caracol, estructura, y función. Camino 1(Izquierda) extraer proteínas de mucina crudas y separarlas de los desechos celulares para obtener masas de secuencia a partir de análisis espectroscópicos y espectrométricos de masas. Camino 2(Derecha) Extracción de ARN de glándulas mucosas o animal entero seguido de de novo ensamblaje de secuencias de genes de mucina para generar una base de datos para BLAST contra mediante una comparación de secuencias ensambladas con una base de datos de mucina conocida, obtenemos secuencias putativas de mucina. Combinando las tuberías proteómicas y de ARN, confirmamos la secuencia de mucina de tipo nativo para su posterior análisis..
Variaciones estructurales de las mucinas
Las mucinas contienen varios dominios que contribuyen a su función general. La variación estructural permite su amplia diversidad biológica y características físicas únicas.. Un dominio de repetición en tándem ubicado en el centro de la columna vertebral de la proteína, rico en serina, treonina, y prolina, sirve como ancla para la glicosilación. Los glicanos de mucina están predominantemente ligados a O, pero pueden estar presentes cantidades menores de glicanos ligados a N. La longitud del dominio de glicosilación y el número de repeticiones difiere entre las mucinas e imparte diferentes características químicas.. Las mucinas secretadas tienen regiones ricas en cisteína en ambos extremos del dominio de repetición en tándem que se utilizan para la estabilización., proporcionar puntos de puente de disulfuro para ambos inter- y enlace intramolecular. Adicionalmente, Estas regiones sirven tanto para proporcionar una diversificación estructural adicional, y permitir la multimerización de mucinas y otras biomoléculas ricas en azufre .
Típicamente, N-acetilgalactosamina (GalNAc) se une al núcleo de la proteína a través de enlaces O-glicosídicos entre el monosacárido y los residuos Ser o Thr (GalNAc[α1]-Ser/Thr). Esto forma el antígeno TN, que se encuentra comúnmente en los seres humanos para estar regulado al alza en ciertos tipos de cáncer . A partir de ahí, la galactosa se anexa a la estructura (Chica[β1-3]GalNAc[α1]-Ser/Thr), formando el núcleo de mucina 1 O-glicano. Los O-glicanos varían en tamaño, De 2 Para 20 residuos de azúcar, y en composición, como otros azúcares como la N-acetilglucosamina (GlcNAc) y fucosa (Fuc) se anexan secuencialmente. Los ácidos siálicos y la manosa también se encuentran en pequeñas cantidades. Ácidos siálicos en particular, se sabe que juegan un papel importante en las propiedades inmunes de las mucinas. El ácido siálico media las interacciones de célula a célula, junto con ser capaz de enmascarar antígenos de macrófagos humanos . Más lejos, Los ácidos siálicos son los principales puntos de unión para las lectinas, una familia de proteínas común que se encuentra en el sistema inmune innato. Adicionalmente, Las mucinas secretadas también exhiben C-manosilación, donde C1 de la manosa se une con el anillo de indol en triptófano, permitiendo una mayor variación de la estructura terciaria .
Cambios sutiles dentro de la estructura de la mucina, en particular, la secuencia de aminoácidos y la glicosilación, puede corresponder a una función biológica muy diferente . Mientras que estas proteínas son predominantemente carbohidratos por peso, hasta 90%, tanto las estructuras de proteínas como las de glicanos proporcionan características funcionales generales a la mucina. Adicionalmente, Las mucinas individuales pueden tener múltiples glicoformas en estados normales y enfermos, y diferentes poblaciones de una sola especie pueden exhibir glicoformas distintas. Esta diversidad permite a los organismos individualizar cada mucina para condiciones fisiológicas y ambientales específicas.. En general, se sabe poco sobre la conexión genotipo-fenotipo de los genes de mucina que conduce a las diversas propiedades funcionales. Se han identificado varios genes de mucina humana y hay al menos 21 genes codificantes de mucina validados, cada uno con diferentes actividades biológicas. En contraste, Si bien se han identificado muchos genes putativos de mucina de caracol, ninguno ha sido validado. Sin embargo, la falta de una caracterización sólida de las diferencias genéticas y estructurales entre los mocos de caracol no ha impedido su aplicación para abordar las necesidades apremiantes de materiales médicos y biotecnológicos..
Mucinas de caracol como agentes antimicrobianos
Las bacterias resistentes a los antibióticos se están convirtiendo en un problema cada vez más frecuente sin muchas soluciones viables.. Porque los moluscos carecen de inmunidad adaptativa, dependen de barreras físicas e inmunidad innata para la protección contra agentes patógenos. Para la mayoría de los caracoles, el pie tiene el mayor contacto con superficies contaminadas con patógenos y parásitos, y la secreción de moco a lo largo de los pies protege contra tales microbios. Uno de los primeros mocos evaluados para la actividad antimicrobiana fue el de Achatina fulica (Caracol terrestre africano gigante). Moco de Un. Fulica demostró una actividad antibacteriana prometedora contra las bacterias Gram-positivas, Bacillus subtilis y Staphylococcus aureus, y las bacterias Gram-negativas, Escherichia coli y Pseudomonas aeruginosa . Las secreciones mucosas de Un. Fulica inhibió el crecimiento bacteriano de ambos S. áureo y S. epidermidis cuando se aplica a través de películas de apósitos para heridas en un modelo de ratón. Los apósitos para heridas mejoraron la maduración del tejido de granulación y la tasa de deposición de colágeno, que se sabe que aceleran el proceso de curación . En un estudio similar, el moco de Hélice rociada actividad antimicrobiana demostrada contra varias cepas de Pseudomonas aeruginosa. Más lejos, el moco de ambos Un. marginata y Un. Fulica, se utilizaron como enrollado en 28 muestras clínicas de heridas recogidas con infecciones comunes conocidas. El moco mostró potencia antibacteriana contra Estafilococo, Estreptococo, y Pseudomonas aislado de heridas. En el mismo estudio, en comparación con siete antibióticos comunes, incluyendo amoxicilina, estreptomicina, y cloranfenicol, algunas de las secreciones de moco eran más inhibitorias a las infecciones que los antibióticos comerciales. Comprender las propiedades antimicrobianas del moco de caracol es un área de investigación activa y creciente.
Especies de moluscos cuya mucina se ha aplicado en diversos sectores para aplicaciones biomédicas o biotecnológicas. Mucina de molusco aplicada como antimicrobianos para inhibir patógenos.
Mucinas de caracol como vehículos de entrega de drogas
La adaptabilidad de los biopolímeros de mucina de caracol los convierte en candidatos excepcionalmente prometedores para nuevos sistemas de administración de fármacos.. Durante el apareamiento, Los caracoles macho disparan un dardo para entregar moco que contiene proteínas accesorias a la hembra, lo que a su vez aumenta la fertilidad del caracol hembra . Este proceso se basa en un sistema multifuncional, con cada componente desempeñando un papel definido. El dardo actúa como una aguja, perforar el tejido e inyectar el moco que transporta las proteínas accesorias en el caracol hembra. De manera similar, el moco podría adaptarse para actuar como vector de entrega de moléculas bioactivas. Se sabe que el moco de caracol se combina excepcionalmente bien con cualquier medicamento que se absorba a través de las membranas mucosas debido a su capacidad para facilitar la difusión a través de las membranas. . Por ejemplo, clorhidrato de metformina, un medicamento para la diabetes, se unió a la mucina de caracol terrestre africano gigante utilizando polietilenglicol (CLAVIJA) para aumentar la biodisponibilidad del fármaco. PEGilación, es un proceso comúnmente utilizado donde un terapéutico está rodeado por una matriz de polímeros predominantemente, polietilenglicol. Esta matriz afecta ventajosamente a la farmacocinética de la terapéutica, prolongar la vida media, a través de la protección contra anticuerpos, y permitir el control variable de la biodistribución en función de la composición de la matriz. La mucina de caracol en particular se muestra prometedora como polímero, ya que son altamente hidrófilos, y también interactúan fácilmente con las membranas mucosas gastrointestinales, un lugar común de absorción de fármacos. La MUCINA espilada cargada con metformina mejoró la farmacocinética y la farmacodinámica del fármaco normalmente mal absorbido, aumentar la liberación a 92% en comparación con el 81% actualmente utilizado en el mercado. En otra aplicación, entero Costus afer (lirio de jengibre) Las flores combinadas con moco de caracol mostraron una reducción de los niveles de glucosa en sangre en diabéticos Mus musculus (Ratones albinos suizos) de una manera dependiente de la dosis, que mostró el posible potencial antidiabético de la mucina de caracol.
La matriz polimérica de unión a fármacos y los cristales de vaterita que contienen mucina se han utilizado como portadores de administración de fármacos para la carga efectiva y la liberación controlada de pequeños medicamentos contra el cáncer y terapias basadas en proteínas.. Microcristales de vaterita, cuando se cristaliza en concentraciones de mucina que oscilan entre 1 y 6 mg/ml, tienen una mejor retención de las bioactividades catiónicas y estabilidad en condiciones fisiológicas Adicionalmente, Las mucinas se han acoplado con fotosensibilizadores para mejorar la orientación y optimizar el control de la administración en células cancerosas. Las cápsulas multicapa de mucina autoensambladas y las micropartículas que contienen mucina son de particular interés para futuros estudios de mecanismos de administración de fármacos de liberación controlada, particularmente para superar los desafíos de la biocompatibilidad, biodegradabilidad, y mucoadhesion.
Mucinas de caracol como agentes antitumorales
La mucina de caracol ha demostrado potencial terapéutico contra el melanoma, uno de los cánceres de piel más peligrosos. Si bien los nuevos desarrollos en la terapia contra el cáncer han resultado en mayores tasas de remisión y mayores esperanzas de vida para los afectados., estos desarrollos no han mostrado rendimientos similares para el melanoma. Como la resistencia al tratamiento es común para este cáncer, existe una necesidad urgente de encontrar nuevos enfoques eficaces para el tratamiento del melanoma. Un estudio de H. apersa el moco en las líneas celulares de melanoma informó que la mucosa del caracol disminuyó la viabilidad e inhibió la metástasis de las células de melanoma. La disminución de la viabilidad de las células se atribuyó a un evento apoptótico relacionado con la escisión del Poli (ADP-ribosa) polimerasa (PARP). Además, la inhibición de la metástasis se logró mediante el bloqueo de la función y la expresión de la integrina., y así inhibir el cáncer de poder crecer. En otro estudio, H. aspersa la mucina inhibió directamente el crecimiento de dos líneas celulares de melanoma humano, al aumentar la expresión de la citoquina TNFα, e inhibiendo NF-κB, un proceso de transcripción que en la regulación adecuada se ha relacionado con la progresión del cáncer, el crecimiento de estas líneas celulares disminuyó, demostrando sus propiedades anti-melanogénicas. Mientras aún se encuentra en las primeras etapas de desarrollo, la aplicación de mucinas de caracol como agentes antitumorales es de creciente interés en la comunidad biomédica.
Las mucinas de caracol facilitan la cicatrización de heridas
El moco de caracol puede facilitar la curación y se ha convertido en un recurso importante en la investigación de heridas. Mucinas de la Hélice rociada (Caracol de jardín) se ha demostrado que ayuda con la regeneración de la piel después de la radiodermatitis aguda, un efecto secundario común de la radioterapia. Según los informes, el moco de caracol de jardín aumentó las tasas de curación a través de la regulación de antioxidantes y radicales libres. El moco del jardín mejoró el eritema en modelos de ratas, y, las mismas ratas también mostraron una reducción del fotoenvejecimiento. Además de poder tratar lesiones superficiales, Las mucinas han demostrado la capacidad de ser utilizadas en heridas internas. Las mucinas se han incorporado junto con los medicamentos antiinflamatorios no esteroideos orales (AINE), para reducir o eliminar la lesión de la mucosa gástrica. Los AINE reducen la inflamación, pero tienen efectos secundarios adversos relacionados con lesión gastrointestinal y daño hepático. Muchas empresas han recurrido a productos naturales para contrarrestar estos efectos secundarios., y se ha demostrado que la mucina trata las úlceras pépticas, a efectos secundarios causados por AINE. Una combinación del antibiótico, claritromicina, y Un. Fulica la mucina ha mostrado resultados positivos en el tratamiento de la úlcera péptica. Además de las propiedades antiulcerosas, la tasa de curación de las úlceras aumentó con la concentración de mucina y fue más rápida que la claritromicina sola.
Moco de caracol utilizado para materiales bioinspirados
El estudio de sustancias naturales como plataforma para construir nuevos materiales ha dado como resultado múltiples productos revolucionarios, como Lipitor, Penicilina, y morfina. Semejantemente, Las mucinas se han utilizado como recubrimiento de biomateriales para reducir el rechazo de los implantes inorgánicos. El rechazo de los implantes quirúrgicos debido a la infección resulta en más de 1 millones de casos médicos por año con el costo de la cirugía original siendo solo una fracción del costo del tratamiento de la infección correspondiente. Aplicación de películas a base de mucina al tereftalato de polietileno, un material común utilizado en implantes médicos, redujo en gran medida la respuesta inmune desencadenada por la absorción de IgG e IgM en el plástico. El mismo estudio también mostró que redujo la activación del fibrinógeno., un agente inflamatorio conocido, al entrar en contacto con el recubrimiento de mucina en comparación con el plástico no recubierto. Se ha demostrado en otros estudios que las mucinas reducen la reproducción de microbios en dispositivos implantados. Las tecnologías basadas en mucina muestran una inmensa promesa para los avances en el campo de los biomateriales.
Un ejemplo de mucinas que se utilizan como biomateriales es la aplicación de mucinas en la síntesis de hidrocarburos solubles en agua.. Ligando mucina y/o compuestos que imitan la mucina con una cadena lipídica hidrofóbica, el complejo de hidrocarburos permaneció suspendido en condiciones acuosas, incluso después de varios meses, mientras que el hidrocarburo no complejado precipitaría rápidamente desde la solución. En otro estudio relacionado realizado por el grupo de Combaa, Esta propiedad se aplicó para mejorar la detección de glucosa mediante la creación de una suspensión estabilizada del complejo nanotubo-mucina de carbono para un biosensor de glucosa tipo sándwich. El dispositivo bioanalítico resultante es 20% más sensible y 40% más rápido que los dispositivos convencionales que no incluyen esta matriz de diseño de sensores.
Mucinas, que entran en contacto con medicamentos absorbidos a través de las membranas mucosas, También se puede utilizar en cromatografía para ayudar a determinar la biodisponibilidad y la absorción a través de la membrana.. Mucina gástrica porcina, unido a la columna de sílice a través de enlazadores aminopropil, permitió la separación de moléculas de fármaco por la afinidad de unión a la membrana mucosa del fármaco. En otro estudio, la mucina se ancló a una columna mediante un intercambio iónico con alginato de calcio, la mucina está inmovilizada, imitando las membranas mucosas biológicas. El tiempo de retención más largo de la molécula dentro de la columna de mucina indicó una alta interacción fármaco-mucina, que se correlaciona con la biodisponibilidad retardada in vivo. Esto agrega otra dimensión para evaluar los medicamentos utilizados en enfermedades específicas que afectan la producción de mucina., como la fibrosis quística.
La misma columna de mucina gástrica porcina se ha utilizado para evaluar la retención del sabor por parte de la industria alimentaria. Se demostró que la columna de mucina imita una lengua bovina para la retención del sabor, lo que reduce la necesidad y podría eliminar potencialmente las pruebas con animales. Las mucinas han sido ampliamente estudiadas en su papel con la percepción del sabor. La presencia de mucinas dentro de la cavidad oral se ha correlacionado directamente con el aumento de la sedimentación de compuestos productores de sabor., lo que a su vez aumenta la percepción del sabor. Este fenómeno también está siendo examinado como la causa de la pérdida del gusto en la vejez.. Se ha observado disminución de los niveles de MUC7 en la saliva en individuos mayores disminución del gusto. Se cree que esta regulación descendente reduce la mucoadhesión de las moléculas de sabor., lo que lleva a una percepción atenuada del gusto.
El ritmo de un caracol para la caracterización de moléculas de mucina
A pesar del creciente interés en el campo, todavía hay muchos obstáculos que impiden los avances en la investigación de la mucina de caracol. Muchas especies de caracoles que tienen el potencial para el descubrimiento de nuevas mucinas a menudo son inaccesibles debido a su hábitat.. La falta de muestras de material biológico de fácil acceso y la dificultad para identificar las estructuras de mucina impiden la síntesis confiable de mucinas en cantidades suficientes para la experimentación repetida.. Varios grupos investigan la sostenibilidad, enfoques escalables para producir mucinas sintéticas, sin embargo el campo está en su infancia mientras mucinas que han sido aisladas de la Un. Fulica han sido ampliamente estudiados, otras especies permanecen descuidadas.
El método más viable para la producción comercial de mucina sigue siendo la extracción y el aislamiento de los animales., que no permite rendimientos sustanciales para su aplicación sin abundante capital animal y generalmente implica métodos invasivos. La complejidad, abundancia, y localización de patrones de glicosilación en cada mucina, Además de varios glicoformatos de mucina causan dificultad en el empleo de métodos de separación comunes para purificar, sintetizar, y analizar muestras de mucina. Las mucinas a menudo sufren modificaciones posttraduccionales, como la O-sulfatación, N-sulfatación, y N-desacetilación que diferencian la función entre proteínas. Estas modificaciones postraduccionales de glicanos son un obstáculo para la purificación de muestras de mucina, caracterización, y síntesis. Un enfoque sintético prometedor implica el uso de bacterias recombinantes, glicosiltransferasa(GT)-polimerización mediada, y transglicosilación. Sin embargo, Estos métodos son insuficientes para lograr rendimientos industrialmente prácticos y no generarán el conjunto exhaustivo de glicoformas que comprenden los geles de moco naturales.. Todavía hay dificultades para crear la O–glicosilación en levadura, y hay desafíos involucrados en la transferencia de ramas de glicosilación a residuos de proteínas elegidos. Estos problemas presentan la necesidad de desarrollar métodos viables y de alto rendimiento para sintetizar mucinas utilizando productos químicos escalables., que sería el primer paso en el uso de mucinas como terapias o tratamientos dirigidos.
En los últimos años han surgido tecnologías -ómicas (genómica, transcriptómica, proteómica, glucómica) que requieren cantidades mínimas de muestras, permitiendo la caracterización de muestras de caracoles raras o poco accesibles. Una estrategia similar a lo que se ha hecho con los venenos de caracol utilizando la venomics, que combina los métodos transcriptómicos y proteómicos con de novo secuencia de programas de ensamblaje bioinformático para identificar la estructura genética de las toxinas peptídicas putativas del veneno de caracol, se puede aplicar para caracterizar genes de mucina y proteínas de moco. Específicamente, tomando las secuencias de nucleótidos de exomas ensamblados, y luego emparejar eso con valores de masa proteómica, podemos confirmar estructuras lineales de proteínas de mucina. En este enfoque extraemos ARNm de glándulas mucosas o animales enteros y a través de una tubería bioinformática, identificar genes de mucina y secuencias primarias de proteínas de mucina. Una nueva iniciativa, el Proyecto Comparativo de Mucomics Animales (CAMPAMENTO) aplicará un análisis comparativo sistemático de genes de mucina e hidrogeles de moco para determinar las estructuras jerárquicas y las propiedades de distintos mocos.
A pesar de la promesa de métodos ómicos para producir bases de datos robustas de mucinas, Aún quedan grandes obstáculos para su estudio. Uno de esos obstáculos son los algoritmos utilizados para ensamblar genes secuenciados. Gráficos de De Bruijn, que es la secuencia de algoritmos que utilizan la mayoría de los ensambladores, tienen dificultad para mapear los dominios repetidos debido a la multiplicidad de secuencias superpuestas similares. Actualmente se están desarrollando múltiples herramientas para superar este problema. . Cada programa cambia la ponderación de los k-mers que se utilizan para construir los gráficos de De Bruijn con el fin de acomodar las repeticiones en tándem. Para el estudio proteómico de la mucina, las interacciones intermoleculares de las mucinas con otras mucinas causan un grado adicional de dificultad. Las mucinas naturalmente crearán multómeros de sí mismos, conectando múltiples proteínas entre sí para formar una estructura más grande, que se observa regularmente en la naturaleza. Para luego obtener una sola proteína, los lazos unidos deben romperse, sin romper también los enlaces de la proteína única. Sin embargo, Los enlaces multimer de mucina son difíciles de reducir sin tener también un efecto sobre el resto de la estructura secundaria de una sola cadena de mucina. Actualmente se utiliza un procedimiento de ensayo y error en estudios proteómicos de mucina para generar masas de proteínas individuales. Será necesario establecer nuevas técnicas de caracterización y síntesis para identificar y fabricar con precisión las mucinas de caracol., y con un enfoque ómico podemos ser capaces de determinar el mapeo de genotipo a fenotipo necesario para comprender y descifrar las diferencias de funcionalidad encontradas en cada muestra de mucina.
Observaciones finales y perspectivas futuras
Los caracoles se encuentran en casi todos los biomas, y las condiciones ambientales parecen impulsar la diversidad de genes de mucina y la versatilidad de las funciones del moco. Las mucinas de caracol han demostrado potencial biomédico y biotecnológico, y son un recurso bioinspirado de gran promesa. La caracterización de las mucinas de caracol no está limitada por su valor inherente., sino por el acceso y la complejidad de la identificación de la molécula, purificación e investigación. Todavía quedan varias preguntas por responder sobre las propiedades de las mucinas y los mocos en relación con los usos aplicables.. Esta perspectiva demuestra el alto potencial de rendimiento de las mucinas de caracol, y mediante la utilización de una tubería ómica comparativa adaptable, podemos entender mejor estas proteínas únicas, y sus ventajosas propiedades biológicas y químicas.
Referencias: Abdulla, Un., Adams, N., Hueso, M., Elliott, Un. M., Gaffin, J., Jones, D., et al. (2013). Orientación sobre el manejo del dolor en personas mayores. Envejecimiento de la edad 42, i1–i57. Doi:10.1093/Envejecimiento/AFS200
Abdullah, L. H., Coakley, R., Webster, M. J., Zhu, Y., Tarran, R., Radicioni, G., et al. (2018). Producción de mucina y respuestas de hidratación a materiales mucopurulentos en epitelios de las vías respiratorias normales versus fibrosis quística. AM. J. Respirar. Crit. Cuidado Med. 197, 481–491. Doi:10.1164/rccm.201706-1139OC
Guchi, S. M. M., Aikawa, T., y Matsumoto, J. J. (1982). Actividad antibacteriana de la mucosidad del caracol Mucina. Comp. Bioquímica. Fisioterapia. Un: Fisioterapia. 72, 571–574. Doi:10.1016/0300-9629(82)90123-2
Lodi, M., Staikou, Un., Janssen, R., y Koene, J. M. (2017). El alto nivel de competencia de espermatozoides puede aumentar la transferencia de productos de glándulas accesorias transportados por el amor Dart of Land Snails. Ecol. Evol. 7, 11148–11156. Doi:10.1002/ECE3,3385 Español
Mamá, J., Rubin, B. K., y Voynow, J. Un. (2018). Mucinas, Moco, y células caliciformes. Pecho 154, 169–176. Doi:10.1016/j.chest.2017.11.008
Martins, M. D. F., Caetano, F. Un. M., Sírio, O. J., Yiomasa, M. M., Mizusaki, C. Yo., y Figueiredo, L. D. (2003). Avaliação macro e microscópica da cicatrização de lesões experimentalmente provocadas em pele de coelhos tratadas com secreção mucoglicoproteica Do escargot Achatina fulica. Braz. J. Veterinario. Res. Anim. Sci. 40, 213. Doi:10.1590/s1413-95962003000900009
Un. Miguel (Editor) (2012). "Múltiples potenciales de biopolímeros tropicales derivados de animales en la administración de fármacos: Lecciones de la mucina de caracol africana," Biopolímeros en la administración de fármacos: Avances y desafíos recientes (Sharjah, UAE: BENTHAM SCIENCE PUBLISHERS), 27–38. Doi:10.2174/978160805078910901010027
Mikheenko, Un., Bzikadze, Un. V., Gurevich, Un., Miga, K. H., y Pevzner, P. Un. (2020). TandemTools: Mapeo de lecturas largas y evaluación/mejora de la calidad del ensamblaje en repeticiones en tándem extralargas. Estropear. Drogas 17, i75–i83. Doi:10.1093/bioinformática/btaa440
Momoh, M. Un., Akpa, P. Un., Ugwu, K. C., Kenechukwu, F. C., y Kenneth, O. C. (2020). Farmacodinámica y farmacocinética Comportamiento de la insulina a partir de micropartículas de MUCINA PEGiladas recubiertas con polímero sensible al pH: Preparación y caracterización. Mamá. Hoy Commun. 25, 101539. Doi:10.1016/j.mtcomm.2020.101539
Momoh, M., Adedokun, M., Adikwu, M., e Ibezim, C. (2014). In vitro evaluación de la matriz de mucina pegilada como portador para la administración oral de clorhidrato de metformina. Trop. J. Pharm. Res. 13, 1039–1045. Doi:10.4314/tjpr.v13i7.5
Mu, Un., Okolie, C. O., y Agboke, Un. (2008). El efecto de la mucina de caracol en la tasa de curación de la úlcera de claritromicina. J. Pharm. Res. 8, 6. Doi:10.18579/jpcrkc/2009/8/1/79523
Mumuni, M. Un., Kenechukwu, F. C., Ofokansi, K. C., Attama, Un. Un., y Díaz, D. D. (2020). Nanopartículas mucoadhesivas cargadas de insulina basadas en complejos de mucina-quitosano para la administración oral y el tratamiento de la diabetes. Carbohidra. Pólipo. 229, 115506. Doi:10.1016/j.carbpol.2019.115506
Navarro, L. Un., Francés, D. L., y Zauscher, S. (2018). Avances en la síntesis de imitación de mucina y aplicaciones en ciencia de superficies. Curr. Opin. Interf coloide. Sci. 38, 122–134. Doi:10.1016/j.cocis.2018.09.004
Nguyen, J. K., Masub, N., y Jagdeo, J. (2020). Ingredientes bioactivos en cosmecéuticos coreanos: Tendencias y evidencia de investigación. J. Cosmet. Dermatol. 19, 1555–1569. Doi:10.1111/jocd.13344
Parque, Y. (2011). Minería de productos naturales de invertebrados para el futuro tesoro terapéutico. NAT. Prod. Municipio. 6 (9), 1403–1408. Doi:10.1177/1934578×1100600944
Pérez-Vilar, J., y Colina, R. L. (1999). La estructura y el ensamblaje de las mucinas secretadas. J. Biol. Chem. 274, 31751–31754. Doi:10.1074/jbc.274.45.31751
Petrou, G., y Crouzier, T. (2018). Mucinas como bloques de construcción multifuncionales de biomateriales. Biomater. Sci. 6, 2282–2297. Doi:10.1039/c8bm0047
Pitt, S. J., Graham, M. Un., Dedi, C. G., Taylor-Harris, P. M., y Gunn, Un. (2015). Propiedades antimicrobianas del moco del caracol de jardín marrón Helix Aspersa. Br. J. Biomed. Sci. 72, 174–181. Doi:10.1080/09674845.2015.11665749
Premi, S. (2020). Papel de la quimioexcitación con melanina en la progresión del melanoma y la resistencia a los medicamentos. Frente. Oncol. 10. Doi:10.3389/Fonc.2020.01305
Pushpass, R.-A. G., Pellicciotta, N., Kelly, C., Proctor, G., y Carpintero, G. H. (2019). La reducción de la unión salival a la mucina y la glicosilación en adultos mayores influye en el gusto en un In vitro Modelo de celda. Nutrientes 11, 2280. Doi:10.3390/nu11102280
Pushpass, R. G., Daly, B., Kelly, C., Proctor, G., y Carpintero, G. H. (2019). Alteración del flujo salival, Composición de proteínas, y Reología después del gusto y estimulación de la PRT en adultos mayores. Frente. Fisioterapia. 10, 652. Doi:10.3389/FPHYS.2019.00652
Rosa, M. C., y Voynow, J. Un. (2006). Genes de mucina del tracto respiratorio y glicoproteínas de mucina en la salud y la enfermedad. Fisioterapia. Rev. 86, 245–278. Doi:10.1152/physrev.00010.2005
Rutkowski, P., y Kozak, K. (2017). Noticias de las Sesiones de Melanoma del Congreso Europeo del Cáncer 2017. BMC Med. 15, 57. Doi:10.1186/S12916-017-0826-4
Sandberg, T., Karlsson Ott, M., Carlsson, J., Feiler, Un., y Caldwell, K. D. (2009). Uso potencial de mucinas como recubrimientos de biomateriales. II. Los recubrimientos de mucina afectan la conformación y las propiedades activadoras de neutrófilos de las proteínas del huésped adsorbidas, hacia una imitación de la mucosa. J. Biomed. Mamá. Res. 91Un, 773–785. Doi:10.1002/jbm.a.32315
Santana, W. Un., Melo, C. M. d., Cardoso, J. C., Pereira-Filho, R. N., Rabelo, Un. S., Reis, F. P., et al. (2012). Evaluación de la actividad antimicrobiana y el potencial curativo de la secreción mucosa de Achatina fulica. Int. J. Morfol. 30, 365–373. Doi:10.4067/S0717-95022012000200001
Sompayrac, L. M. (2012). Cómo funciona el sistema inmunitario. 4ª Edición.
Van Putten, J. P. M., y Strijbis, K. (2017). Mucinas transmembrana: Receptores de señalización en la intersección de la inflamación y el cáncer. J. Immun innato. 9, 281–299. Doi:10.1159/000453594
Furgoneta, H., Hjorth, M., Winkeljann, B., Dobryden, Yo., Lieleg, O., y Crouzier, T. (2020). Glico-modificación de hidrogeles de mucina para investigar su actividad inmune. Aplicación ACS. Mamá. Enterrar. 12, 19324–19336. Doi:10.1021/ACSAMI.0c03645
Los autores: Maxwell McDermott, Antonio R. Cerullo, James Parziale, Eleonora Achrak, Sharmin Sultana,Jennifer Ferd, Safiyah Samad, Guillermo Deng, Adán B. Brunswick, Mandë Holford.




 Gastromucina Mucus pro 260
Gastromucina Mucus pro 260  Estación de filtrado de vacío Mucus filter III
Estación de filtrado de vacío Mucus filter III