Mucyny są wysoce glikozylowaną rodziną białek, które są wydzielane przez zwierzęta w celu adhezji, Nawilżenie, smarowanie, i inne funkcje. Pomimo ich wszechobecności, mucyny zwierzęce są w dużej mierze niescharakteryzowane. Ślimaki wytwarzają białka mucyny w śluzie dla szerokiego zakresu funkcji biologicznych, w tym ochrona mikrobiologiczna, przyczepność i smarowanie. Niedawno, mucyny ślimaków stały się również lukratywnym źródłem innowacji o szerokim zakresie zastosowań w chemii, biologia, biotechnologia, i biomedycyna. Specyficznie, śluzy ślimaków zostały zastosowane jako produkty do pielęgnacji skóry, środki gojące rany, kleje chirurgiczne, oraz do zwalczania wrzodów żołądka. Ostatnie postępy w zintegrowanej omice (Genomowego, transkryptomia, proteomiczny, glikomiczny) technologie poprawiły charakterystykę mucyn ślimaków, zwiększenie wytwarzania nowych biomateriałów. Ta perspektywa opisuje obecne badania nad wydzielanym śluzem ślimaka, podkreślenie potencjału tego biopolimeru, a także nakreśla strategię badawczą w celu zaspokojenia niezaspokojonej potrzeby zbadania hierarchicznych struktur, które prowadzą do ogromnej różnorodności biologicznej i chemicznej genów śluzu ślimaka.
Wprowadzenie
Intryga w śluzowych śladach śluzu pozostawionych przez ślimaki i ślimaki sięga starożytnej Grecji, gdzie wykorzystali śluz ze względu na jego zdolność do zmniejszania stanu zapalnego i oznak starzenia się. Dziś śluz ślimaka jest nadal stosowany w produktach do pielęgnacji skóry przez różne firmy i jest rosnącym rynkiem, którego wartość ma się zbliżyć $770 milionów przez 2025. Pomimo zastosowań komercyjnych, dziedzina badań nad śluzem pozostaje zaskakująco słabo rozwinięta. Głównym składnikiem odpowiedzialnym za właściwości śluzu są wydzielane mucyny, rodzina silnie glikozylowanych białek wytwarzanych w komórkach nabłonkowych u większości zwierząt. Mucyny są albo związane z błoną plazmatyczną, albo wydzielane z komórki, a każdy typ ma duże różnice w swoich funkcjach i możliwościach. Mucyny związane z błoną są glikolipidami, które działają jako markery sygnalizacji komórkowej, a także chronią komórkę przed pozakomórkowymi afrontami, które mogą prowadzić do uszkodzenia, takie jak infekcje i wysiłek fizyczny . Wydzielane mucyny mogą być biopolimerami tworzącymi żel lub nietwórzymi żelu. Wydzielane biopolimery tworzą makroskopową skalę błon śluzowych. Te błony śluzowe stanowią dużą część powierzchni organizmów wielokomórkowych narażonych na działanie środowiska.. U ludzi, błony śluzowe odpowiadają za 99% powierzchni ciała. Każdy gatunek ślimaka wydziela wiele odrębnych śluzów funkcjonalnych. Śluz wytwarzany przez stopę ślimaka służy do przyczepności i smarowania, pozwalając ślimakowi przykleić się lub przejść przez dowolną powierzchnię, nawet po odwróceniu. Dodatkowo, śluz wytwarzany z tyłu ślimaka jest wykorzystywany do obrony mikrobiologicznej i nawodnienia tkanek. Niektóre gatunki ślimaków mają specjalistyczne zastosowania śluzu. Na przykład, Falsilunatia eltanini (Ślimak księżycowy) używa śluzu do ochrony jaj, i Tikoconus costarricanus (Kostarykański ślimak lądowy), wykorzystuje śluz do czynności nośnych, takie, aby ukryć się przed słońcem na dnie liści podczas suszy. Ostatnie postępy w omice (Genomowego, transkryptomia, proteomiczny, glikomika) technologie rozszerzyły eksplorację mucyn ślimaków jako zasobu naukowego o szerokim zakresie zastosowań w chemii, biologia, biotechnologia, i medycyna. Na przykład, właściwości przeciwdrobnoustrojowe śluzu ślimaka są wykorzystywane do zwalczania zaburzeń obserwowanych u ludzi, począwszy od wrzodów żołądka, do zakażeń pooperacyjnych. Mucyny są również łączone z zatwierdzonymi lekami w celu wzmocnienia zdolności leku do leczenia chorób, takie jak cukrzyca i wrzodziejące zapalenie jelita grubego. Dodatkowo, mucyny ślimaków są badane w szerokim zakresie innych zastosowań biotechnicznych, które wykorzystują ich właściwości podobne do środków powierzchniowo czynnych. . Pomimo ich potencjału, niewiele wiadomo o tym, w jaki sposób hierarchiczne struktury mucynowe odpowiadają za ich różnorodne właściwości funkcjonalne. Istnieje niezaspokojona potrzeba zbadania biologicznej i chemicznej różnorodności genów mucyny ślimaka w celu wyjaśnienia zasad przewodnich, które określają różnorodne właściwości związane z każdym genem.. Ten artykuł perspektywiczny podkreśli obecne zastosowania wydzielanego śluzu ślimaka, które demonstrują potencjał tego biopolimeru jako zasobu dla postępu biotechnologicznego i biomedycznego. Opiszemy również zintegrowaną strategię omiki do badania różnorodności biologicznej i chemicznej genów śluzu ślimaka.
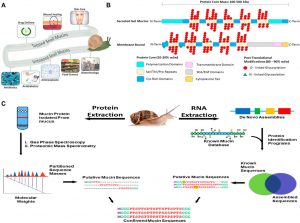
(A) Zastosowania śluzu ślimaka. Śluz ślimaka został użyty do pielęgnacji skóry, gojenie i odmładzanie ran, i dostarczanie leków. Śluz ślimaka jest badany w naukach o żywności, powłoki implantów, a inne sektory biotechnologiczne prowadzą obecnie badania nad mucynami, które mają zostać zbadane pod kątem potencjalnego zastosowania. (B) 2-wymiarowa reprezentacja struktur mucyny. Mucyny charakteryzują się dwiema częściami swojej struktury, ich rdzeń białkowy, i ich rozgałęzienie glikanowe. Rdzeń białkowy jest sekwencją białkową o zmiennej długości w zależności od genu mucyny, który został dodatkowo zmodyfikowany za pomocą gałęzi glikozylacji. Struktura białka, jednak ma wiele domen, a domeny te różnią się w zależności od funkcji i lokalizacji komórkowej mucyny. Gałęzie glikanów są gałęziami cukrowymi, począwszy od 3 do 18 cukry, i stanowią większość masy mucyny. Pokazane są 2 reprezentacje wymiarowe różnych typów mucyn, i ich stereotypowe cechy. (C) Zastosowanie zintegrowanego podejścia omiki do identyfikacji sekwencji mucyny ślimaka, struktura, i funkcja. Ścieżka 1(Lewy) ekstrahować surowe białka mucyny i oddzielać od resztek komórkowych w celu uzyskania mas sekwencyjnych z analiz spektroskopowych i spektrometrycznych mas. Ścieżka 2(Prawy) Ekstrakcja RNA z gruczołów śluzowych lub całego zwierzęcia, a następnie de novo montaż sekwencji genów mucyny w celu wygenerowania bazy danych do BLAST poprzez porównanie zmontowanych sekwencji ze znaną bazą danych mucyny, otrzymujemy domniemane sekwencje mucynowe. Łącząc rurociągi proteomiczne i RNA potwierdzamy natywną sekwencję mucyny typu do dalszej analizy.
Strukturalne wariacje mucyn
Mucyny zawierają kilka domen, które przyczyniają się do ich ogólnej funkcji. Zmienność strukturalna pozwala na ich rozległą różnorodność biologiczną i unikalne cechy fizyczne. Domena powtórzeń tandemowych znajdująca się w centrum szkieletu białka, bogaty w serynę, treonina, i prolina, służy jako kotwica do glikozylacji. Glikany mucynowe są głównie O-linked, ale mogą występować niewielkie ilości glikanów związanych z N. Długość domeny glikozylacji i liczba powtórzeń różni się w zależności od mucyny i nadaje różne właściwości chemiczne. Wydzielane mucyny mają bogate w cysteinę regiony na obu końcach domeny powtórzeń tandemowych, które są używane do stabilizacji, zapewnienie punktów mostkowych dwusiarczkowych dla obu inter- i wiązanie wewnątrzcząsteczkowe. Dodatkowo, regiony te służą zarówno zapewnieniu dodatkowej dywersyfikacji strukturalnej, i pozwalają na multimeryzację mucyn i innych biomolekuł bogatych w siarkę .
Typowo, N-acetylogalaktozoamina (GalNAc) jest przyłączony do rdzenia białkowego poprzez wiązania O-glikozydowe między monosacharydem a pozostałościami Ser lub Thr (GalNAc[α1]-Ser/Thr). Tworzy to antygen TN, który jest powszechnie spotykany u ludzi, aby być w górę regulowany w niektórych nowotworach . Stamtąd, galaktoza jest dołączana do struktury (Gal[β1-3]GalNAc[α1]-Ser/Thr), tworząc rdzeń mucyny 1 O-glikan. O-glikany różnią się wielkością, z 2 do 20 pozostałości cukru, i w składzie, jako inne cukry, takie jak N-acetyloglukozamina (GlcNAc) i fukoza (Fuc •) są dodawane sekwencyjnie. Kwasy sialowe i mannoza występują również w śladowych ilościach. W szczególności kwasy sialowe, wiadomo, że odgrywają ważną rolę w właściwościach immunologicznych mucyn. Kwas sialowy pośredniczy w interakcjach między komórkami, wraz z możliwością maskowania antygenów z ludzkich makrofagów . Dalej, kwasy sialowe są głównymi punktami wiązania lektyn, wspólna rodzina białek występujących we wrodzonym układzie odpornościowym. Dodatkowo, wydzielane mucyny również wykazują C-mannozylację, gdzie C1 mannozy wiąże się z pierścieniem indolowym w tryptofanie, pozwalające na większe zróżnicowanie struktury trzeciorzędowej .
Subtelne zmiany w strukturze mucyny, w szczególności sekwencja aminokwasowa i glikozylacja, może odpowiadać bardzo różnym funkcjom biologicznym . Podczas gdy białka te są głównie węglowodanami wagowo, do 90%, zarówno struktury białkowe, jak i glikanowe zapewniają ogólną charakterystykę funkcjonalną mucyny. Dodatkowo, poszczególne mucyny mogą mieć wiele glikoform w stanie normalnym i chorym, a różne populacje pojedynczego gatunku mogą wykazywać różne glikoformy. Ta różnorodność pozwala organizmom na indywidualizację każdej mucyny w określonych warunkach fizjologicznych i środowiskowych.. Ogólnie rzecz biorąc, niewiele wiadomo na temat związku genów mucyny z fenotypem, który prowadzi do różnych właściwości funkcjonalnych.. Zidentyfikowano kilka ludzkich genów mucyny i istnieją co najmniej 21 zwalidowane geny kodujące mucynę, każdy z inną aktywnością biologiczną. Natomiast, podczas gdy zidentyfikowano wiele domniemanych genów mucyny ślimaka, żaden z nich nie został zatwierdzony. Jednak, brak solidnej charakterystyki genetyki i różnic strukturalnych między śluzami ślimaków nie wykluczył ich zastosowania w celu zaspokojenia pilnych potrzeb w zakresie materiałów medycznych i biotechnologicznych.
Mucyny ślimaków jako środki przeciwdrobnoustrojowe
Bakterie oporne na antybiotyki stają się coraz bardziej powszechnym problemem bez wielu realnych rozwiązań. Ponieważ nie mają odporności adaptacyjnej, zależą od barier fizycznych i wrodzonej odporności w celu ochrony przed czynnikami chorobotwórczymi. Dla większości ślimaków, stopa ma największy kontakt z powierzchniami zanieczyszczonymi patogenami i pasożytami, a wydzielanie śluzu wzdłuż stóp chroni przed takimi drobnoustrojami. Jednym z najwcześniejszych śluzów ocenianych pod kątem aktywności przeciwdrobnoustrojowej był śluz Achatina fulica (Gigantyczny afrykański ślimak lądowy). Śluz z A. fulica wykazano obiecujące działanie przeciwbakteryjne przeciwko bakteriom Gram-dodatnim, Bacillus subtilis i Staphylococcus aureus, i bakterie Gram-ujemne, Escherichia coli i Pseudomonas aeruginosa . Wydzieliny śluzu A. fulica hamował rozwój bakterii obu S. Aureus i S. epidermidis po nałożeniu za pomocą folii do opatrunku na rany na model myszy. Opatrunki na rany poprawiły dojrzewanie tkanki ziarninowej i szybkość odkładania się kolagenu, o których wiadomo, że przyspieszają proces gojenia . W podobnym badaniu, śluz Helix aspersa wykazano działanie przeciwdrobnoustrojowe przeciwko kilku szczepom Pseudomonas aeruginosa. Dalej, śluz obu A. marginata i A. fulica, były stosowane jako opatrunek na rany 28 kliniczne próbki ran pobrane ze znanymi powszechnymi infekcjami. Śluz wykazał działanie antybakteryjne przeciwko Staphylococcus, Streptococcus, i Pseudomonas izolowany od ran. W tym samym badaniu, w porównaniu z siedmioma powszechnymi antybiotykami, w tym amoksycylina, Streptomycyny, i chloramfenikol, niektóre wydzieliny śluzu były bardziej hamujące infekcje niż komercyjne antybiotyki. Zrozumienie właściwości przeciwdrobnoustrojowych śluzu ślimaka jest aktywnym i rosnącym obszarem badań.


Gatunki, których mucyna była stosowana w różnych sektorach do zastosowań biomedycznych lub biotechnologicznych. Mucyna stosowana jako środki przeciwdrobnoustrojowe w celu zahamowania patogenów.
Mucyny ślimaków jako pojazdy do dostarczania narkotyków
Zdolność adaptacyjna biopolimerów mucyny ślimaków czyni je wyjątkowo obiecującymi kandydatami do nowych systemów dostarczania leków. Podczas krycia, samce ślimaków strzelają rzutką, aby dostarczyć śluz zawierający dodatkowe białka do samicy, co z kolei zwiększa płodność samicy ślimaka . Proces ten opiera się na wielofunkcyjnym systemie, z każdym komponentem odgrywającym określoną rolę. Strzałka działa jak igła, przekłuwanie tkanki i wstrzykiwanie śluzu, który przenosi białka dodatkowe do samicy ślimaka. W podobny sposób, śluz może być przystosowany do działania jako wektor dostarczania bioaktywnych cząsteczek. Wiadomo, że śluz ślimaka wyjątkowo dobrze łączy się z każdym lekiem, który jest wchłaniany przez błony śluzowe ze względu na ich zdolność do ułatwiania dyfuzji przez błony. . Na przykład, chlorowodorek metforminy, lek na cukrzycę, został dołączony do Giant African Land Snail mucin przy użyciu glikolu polietylenowego (CZOP) w celu zwiększenia biodostępności leku. PEGylacja, jest powszechnie stosowanym procesem, w którym terapia jest otoczona matrycą polimerów głównie, glikol polietylenowy. Matryca ta korzystnie wpływa na farmakokinetykę terapii, wydłużenie okresu półtrwania, poprzez ochronę przed przeciwciałami, oraz umożliwienie zmiennej kontroli biodystrybucji w zależności od składu matrycy. Mucyna ślimaka w szczególności wykazuje się obiecującym polimerem, ponieważ są wysoce hydrofilowe, a także łatwo wchodzi w interakcje z błonami śluzowymi przewodu pokarmowego, wspólne miejsce wchłaniania leków. Wypełniona metforminą PEGylowana mucyna poprawiła farmakokinetykę i farmakodynamikę normalnie słabo wchłanianego leku, zwiększenie uwalniania do 92% w porównaniu z 81% obecnie stosowane na rynku. W innej aplikacji, cały Costus afer (lilia imbirowa) kwiaty w połączeniu ze śluzem ślimaka wykazały obniżenie poziomu glukozy we krwi u diabetyków Mus musculus (Szwajcarskie myszy albinosy) w sposób zależny od dawki, który wykazał możliwy potencjał przeciwcukrzycowy mucyny ślimaka.
Wiążąca leki matryca polimerowa i kryształy vaterytu zawierające mucynę zostały wykorzystane jako nośniki leków do skutecznego ładowania i kontrolowanego uwalniania małych leków przeciwnowotworowych i leków na bazie białka. Mikrokryształy Vaterytu, po skrystalizowaniu w stężeniach mucyny w zakresie od 1 i 6 mg/ml, mają lepszą retencję bioaktywności kationowej i stabilność w warunkach fizjologicznych Dodatkowo, mucyny zostały połączone z fotouczulaczami w celu zwiększenia ukierunkowania i optymalizacji kontroli dostarczania do komórek nowotworowych. Samodzielnie zmontowane wielowarstwowe kapsułki mucyny i mikrocząsteczki zawierające mucynę są szczególnie interesujące dla przyszłych badań nad mechanizmami dostarczania leków o kontrolowanym uwalnianiu, w szczególności w celu przezwyciężenia wyzwań związanych z biokompatybilnością, rozkład biologiczny, i mukoazja.
Mucyny ślimaków jako środki przeciwnowotworowe
Mucyna ślimaka wykazała potencjał terapeutyczny przeciwko czerniakowi, jeden z najniebezpieczniejszych nowotworów skóry. Podczas gdy nowe osiągnięcia w terapii przeciwnowotworowej spowodowały większe wskaźniki remisji i dłuższą oczekiwaną długość życia osób dotkniętych chorobą, zmiany te nie wykazały podobnych plonów dla czerniaka. Ponieważ oporność na leczenie jest powszechna w przypadku tego nowotworu, istnieje pilna potrzeba znalezienia skutecznych nowych podejść do leczenia czerniaka. Badanie H. apersa śluz na liniach komórkowych czerniaka poinformował, że śluz ślimaka zmniejsza żywotność i hamuje przerzuty komórek czerniaka. Spadek żywotności komórek przypisano zdarzeniu apoptotycznemu związanemu z rozszczepieniem Poly (ADP-ryboza) Polimerazy (PARP). Dodatkowo zahamowanie przerzutów osiągnięto poprzez zablokowanie funkcji i ekspresji integryny., a tym samym hamując raka przed wzrostem. W innym badaniu, H. aspersa mucyna bezpośrednio hamowała wzrost dwóch linii komórkowych czerniaka ludzkiego, poprzez zwiększenie ekspresji cytokiny TNFα, i hamowanie NF-kB, proces transkrypcji, który w odpowiedniej regulacji został powiązany z progresją raka, wzrost tych linii komórkowych był zmniejszony, wykazujący właściwości antymelaogenne. Będąc jeszcze we wczesnych stadiach rozwoju, zastosowanie mucyn ślimaków jako środków przeciwnowotworowych cieszy się rosnącym zainteresowaniem w środowisku biomedycznym.
Mucyny ślimaków ułatwiają gojenie się ran
Śluz ślimaka może ułatwić gojenie i stał się ważnym zasobem w badaniach nad ranami. Mucyny z Helix aspersa (Ślimak ogrodowy) wykazano, że pomagają w regeneracji skóry po ostrym radiodermatitis, częste działanie niepożądane radioterapii. Śluz ślimaka ogrodowego podobno zwiększył tempo gojenia poprzez regulację antyoksydacyjną i wolnych rodników. Śluz z ogrodu poprawił rumień w modelach szczurów, i, te same szczury wykazały również zmniejszenie fotostarzenia. A także możliwość leczenia powierzchownych urazów, mucyny wykazały zdolność do stosowania na rany wewnętrzne. Mucyny zostały włączone wraz z doustnymi niesteroidowymi lekami przeciwzapalnymi (NLPZ), w celu zmniejszenia lub wyeliminowania uszkodzenia błony śluzowej żołądka. NLPZ zmniejszają stan zapalny, ale mają niepożądane skutki uboczne związane z uszkodzeniem przewodu pokarmowego i uszkodzeniem wątroby. Wiele firm zwróciło się do produktów naturalnych, aby przeciwdziałać tym skutkom ubocznym, i Wykazano, że mucyna leczy wrzody trawienne, działania niepożądane spowodowane przez NLPZ. Połączenie antybiotyku, klarytromycyna, i A. fulica mucyna wykazała pozytywne wyniki w leczeniu choroby wrzodowej. Oprócz właściwości przeciwwrzodowych, szybkość gojenia się wrzodów wzrastała wraz ze stężeniem mucyny i była szybsza niż sama klarytromycyna.
Śluz ślimaka używany do materiałów bioinspirowanych
Badanie naturalnie występujących substancji jako platformy do budowy nowych materiałów zaowocowało wieloma rewolucyjnymi produktami, takich jak Lipitor, Penicylina, i morfina. Podobnie, mucyny zostały zastosowane jako powłoka biomateriałowa w celu zmniejszenia odrzucania implantów nieorganicznych. Odrzucenie implantów chirurgicznych z powodu infekcji powoduje ponad 1 milionów przypadków medycznych rocznie, przy czym koszt pierwotnej operacji stanowi tylko ułamek kosztów leczenia odpowiedniej infekcji. Nakładanie folii na bazie mucyny do politereftalanu etylenu, wspólny materiał stosowany w implantach medycznych, znacznie zmniejszył odpowiedź immunologiczną wywołaną wchłanianiem IgG i IgM do plastiku. To samo badanie wykazało również, że zmniejsza aktywację fibrynogenu, znany czynnik zapalny, podczas kontaktu z powłoką mucynową w porównaniu z niepowlekanym tworzywem sztucznym. W innych badaniach wykazano, że mucyny zmniejszają reprodukcję drobnoustrojów na wszczepionych urządzeniach. Technologie oparte na mucynie wykazują ogromną obietnicę postępu w dziedzinie biomateriałów.
Przykładem stosowania mucyn jako biomateriałów jest zastosowanie mucyn w syntezie rozpuszczalnych w wodzie węglowodorów. Poprzez ligating mucyny i/lub związków naśladujących mucynę z hydrofobowym łańcuchem lipidowym, kompleks węglowodorowy pozostawał zawieszony w warunkach wodnych, nawet po kilku miesiącach, podczas gdy nieskompleksowany węglowodór szybko wytrącałby się z roztworu. W innym powiązanym badaniu przeprowadzonym przez grupę Combaa, ta właściwość została zastosowana w celu zwiększenia wykrywania glukozy poprzez stworzenie stabilizowanej zawiesiny kompleksu nanorurek węglowych-mucyny dla biosensora glukozy typu kanapkowego. Powstałe urządzenie bioanalityczne jest 20% bardziej wrażliwy i 40% szybsze niż konwencjonalne urządzenia, które nie zawierają tej matrycy projektowej czujnika.
Mucyny, które wchodzą w kontakt z lekami wchłanianymi przez błony śluzowe, może być również stosowany w chromatografii, aby pomóc w określeniu biodostępności i absorpcji przez membranę. Świńska mucyna żołądka, związane z kolumną krzemionkową za pomocą łączników aminopropylowych, dozwolone do oddzielania cząsteczek leku przez powinowactwo wiązania błony śluzowej leku. W innym badaniu mucyna została zakotwiczona w kolumnie za pomocą wymiany jonowej z alginianem wapnia, mucyna jest unieruchomiona, naśladując biologiczne błony śluzowe. Dłuższy czas retencji cząsteczki w kolumnie mucyny wskazywał na wysoką interakcję lek-mucyna, co jest skorelowane z opóźnioną biodostępnością in vivo. Dodaje to kolejny wymiar do oceny leków stosowanych w określonych chorobach, które wpływają na produkcję mucyny., takie jak mukowiscydoza.
Ta sama kolumna mucyny żołądkowej świń została wykorzystana do oceny retencji smaku przez przemysł spożywczy. Wykazano, że kolumna mucyny naśladuje język bydlęcy w celu zachowania smaku, co zmniejsza potrzebę i może potencjalnie wyeliminować testy na zwierzętach. Mucyny zostały szeroko zbadane pod kątem ich roli w percepcji smaku. Obecność mucyn w jamie ustnej została bezpośrednio skorelowana ze zwiększoną sedymentacją związków wytwarzających smak, co z kolei zwiększa percepcję smaku. Zjawisko to jest również badane jako przyczyna utraty smaku w starszym wieku.. Obniżony poziom MUC7 w ślinie obserwowano u osób starszych o obniżonym smaku. Uważa się, że ta regulacja w dół zmniejsza mukoadhezję cząsteczek smaku, co prowadzi do osłabienia percepcji smaku.
Ślimacze tempo charakteryzacji cząsteczek mucyny
Pomimo rosnącego zainteresowania tą dziedziną, nadal istnieje wiele przeszkód, które uniemożliwiają postęp w badaniach nad mucyną ślimaków. Wiele gatunków ślimaków, które mają potencjał do odkrywania nowych mucyn, jest często niedostępnych ze względu na ich siedlisko. Brak łatwo dostępnych próbek materiału biologicznego i trudności w identyfikacji struktur mucyny uniemożliwiają wiarygodną syntezę mucyn w ilościach wystarczających do wielokrotnych eksperymentów.. Kilka grup bada zrównoważony rozwój, skalowalne podejście do produkcji syntetycznych mucyn, jednak pole jest w powijakach Podczas gdy mucyny, które zostały wyizolowane z A. fulica zostały szeroko przebadane, inne gatunki pozostają zaniedbane.
Najbardziej opłacalną metodą komercyjnej produkcji mucyny pozostaje ekstrakcja i izolacja od zwierząt, który nie pozwala na znaczne plony do stosowania bez obfitego kapitału zwierzęcego i generalnie obejmuje metody inwazyjne. Złożoność, obfitość, i lokalizacja wzorców glikozylacji na każdej mucynie, oprócz różnych glikoform mucyny powodują trudności w stosowaniu wspólnych metod separacji w celu oczyszczenia, Syntezy, i analizuj próbki mucyny. Mucyny często ulegają modyfikacjom potranslacyjnym, takie jak O-siarczanowanie, N-siarczanowanie, i N-deacetylacja, które różnicują funkcję między białkami. Te potranslacyjne modyfikacje glikanów są przeszkodą w oczyszczaniu próbek mucyny, Charakterystyka, i synteza. Obiecujące podejście syntetyczne polega na zastosowaniu rekombinowanych bakterii, glikozylotransferaza(Gt)-polimeryzacja za pośrednictwem, i transglikozylacji. Jednak, metody te są niewystarczające do osiągnięcia praktycznych plonów przemysłowych i nie wygenerują wyczerpującego zestawu glikoform, które zawierają naturalne żele śluzu. Nadal istnieją trudności w tworzeniu O–glikozylacja w drożdżach, i istnieją wyzwania związane z przenoszeniem gałęzi glikozylacji do wybranych reszt białkowych. Zagadnienia te wskazują na potrzebę opracowania realnych i wysokowydajnych metod syntezy mucyn przy użyciu skalowalnych substancji chemicznych., co byłoby pierwszym krokiem do stosowania mucyn jako terapii celowanych lub zabiegów.
W ostatnich latach pojawiły się technologie -omiczne (genomika, transkryptomika, proteomika, glikomika) które wymagają minimalnych ilości próbek, pozwalające na scharakteryzowanie rzadkich lub słabo dostępnych próbek ślimaków. Strategia podobna do tej, co zrobiono z jadami ślimaków za pomocą jadu, który łączy metody transkryptomiczne i proteomiczne z de novo sekwencjonowanie bioinformatycznych programów montażowych w celu identyfikacji struktury genetycznej domniemanych toksyn peptydowych jadu ślimaka, może być stosowany do charakteryzowania genów mucyny i białek śluzu. Specyficznie, pobierając sekwencje nukleotydowe złożonych egzomów, a następnie sparowanie tego z proteomicznymi wartościami masy, możemy potwierdzić liniowe struktury białka mucyny. W tym podejściu ekstrahujemy mRNA z gruczołów śluzowych lub całego zwierzęcia i poprzez bioinformatyczny rurociąg, identyfikacja genów mucyny i pierwotnych sekwencji białek mucyny. Nowa inicjatywa, Projekt Porównawczy Mukomika Zwierzęca (OBÓZ) zastosuje systematyczne analizy porównawcze genów mucyny i hydrożeli śluzu w celu określenia hierarchicznych struktur i właściwości różnych śluzów.
Pomimo obietnicy omicznych metod tworzenia solidnych baz danych mucyn, nadal istnieją poważne przeszkody dla ich badań. Jedną z takich przeszkód są algorytmy używane do łączenia zsekwencjonowanych genów. Wykresy De Bruijna, która jest sekwencją algorytmu używaną przez większość asemblerów, mają trudności z mapowaniem powtarzających się domen ze względu na wielość podobnych nakładających się sekwencji. Obecnie opracowywanych jest wiele narzędzi w celu przezwyciężenia tego problemu . Każdy program zmienia wagę k-merów, które są używane do konstruowania wykresów De Bruijna w celu dostosowania się do powtórzeń tandemowych. Do badania proteomicznego mucyny, interakcje międzycząsteczkowe mucyn z innymi mucynami powodują dodatkowy stopień trudności. Mucyny naturalnie stworzą multimery same z siebie, łączenie wielu białek w celu utworzenia większej struktury, który jest regularnie obserwowany w przyrodzie. Aby następnie uzyskać pojedyncze białko, połączone więzy muszą zostać zerwane, bez zerwania wiązań pojedynczego białka. Jednak, wiązania multimerowe mucyny są trudne do zredukowania bez wpływu na resztę struktury wtórnej pojedynczego łańcucha mucyny. Procedura prób i błędów jest obecnie stosowana w badaniach proteomicznych mucyny w celu wytworzenia pojedynczych mas białkowych. Konieczne będzie ustanowienie nowych technik charakteryzacji i syntezy, aby dokładnie identyfikować i wytwarzać mucyny ślimaków., a dzięki podejściu omicznemu możemy być w stanie określić mapowanie genotypu do fenotypu niezbędne do zrozumienia i rozszyfrowania różnic funkcjonalnych znalezionych w każdej próbce mucyny.
Uwagi końcowe i perspektywy na przyszłość
Ślimaki znajdują się w prawie każdym biomie, i warunki środowiskowe wydają się napędzać różnorodność genów mucyny i wszechstronność funkcji śluzu. Mucyny ślimaków wykazały potencjał biomedyczny i biotechnologiczny, i są bioinspirowanym zasobem o znaczącej obietnicy. Charakterystyka mucyn ślimaków nie jest ograniczona ich wrodzoną wartością, ale przez dostęp i złożoność identyfikacji cząsteczki, oczyszczanie i badanie. Pozostaje jeszcze kilka pytań, na które należy odpowiedzieć na temat właściwości mucyn i śluzów w odniesieniu do stosowanych zastosowań. Ta perspektywa pokazuje wysoki potencjał plonowania mucyn ślimaków, oraz poprzez wykorzystanie adaptowalnego potoku omiki porównawczej, możemy lepiej zrozumieć te unikalne białka, oraz ich korzystne właściwości biologiczne i chemiczne.

Odwołania: Abdulla, A., Adams, N., Kość, M., Elliott, A. M., Gaffin •, J., Jones, D., Wsp. (2013). Wytyczne dotyczące leczenia bólu u osób starszych. Starzenie się 42, i1–i57. Doi:10.1093/starzenie/afs200
Abdullah •, L. H., Coakley •, R., Webster, M. J., Zhu •, Y., Tarran •, R., Radicioni, G., Wsp. (2018). Produkcja mucyny i reakcje nawodnienia na materiały mukoropne w normalnym porównaniu z mukowiscydozą Nabłonek dróg oddechowych. Am. J. Respir. Crit. Care Med. 197, 481–491. Doi:10.1164/rccm.201706-1139oc
Zapalenie skóry: Prezentacja kliniczna, Patofizjologii, i Leczenie 2006. J. Am. Acad. Dermatol. 54, 28–46. Doi:10.1016/j.jaad.08.054.2005
guchi •, S. M. M., Aikawa •, T., i Matsumoto, J. J. (1982). Działanie przeciwbakteryjne śluzu ślimaka Mucin. Komp. Biochem. Fizjolina. A: Fizjolina. 72, 571–574. Doi:10.1016/0300-9629(82)90123-2
Lipa, S. K., Sutton, P., Karlsson •, N. G., Korolik •, V., i McGuckin, M. A. (2008). Mucyny w barierze błony śluzowej do infekcji. Immunol błony śluzowej. 1, 183–197. Doi:10.1038/mi.2008.5
Lodi, M., Staikou •, A., Janssen, R., i Koene, J. M. (2017). Wysoki poziom konkurencji plemników może zwiększyć transfer dodatkowych produktów gruczołowych przenoszonych przez Love Dart ślimaków lądowych. Ecol. Evol. 7, 11148–11156. Doi:10.1002/ECE3,3385
Ma, J., Rubin, B. K., i Voynow, J. A. (2018). Mucyny, Śluz, i Komórki Kielicha. Klatka piersiowa 154, 169–176. Doi:10.1016/j.chest.2017.11.008
Martins, M. D. F., Caetano, F. A. M., Sírio •, O. J., Yiomasa •, M. M., Mizusaki •, C. Ja., i Figueiredo, L. D. (2003). Avaliação macro e microscópica da cicatrização de lesões experimentalmente provocadas em pele de coelhos tratadas com secreção mucoglicoproteica Do escargot Achatina fulica. Braz. J. Weterynarz. Res. Anim. Sci. 40, 213. Doi:10.1590/s1413-95962003000900009
A. Michael (Redaktor) (2012). "Wielorakie potencjały biopolimerów pochodzenia tropikalnego pochodzenia zwierzęcego w dostarczaniu leków: Lekcje od afrykańskiego ślimaka Mucin," Biopolimery w dostarczaniu leków: Ostatnie postępy i wyzwania (Szardża, ZEA: WYDAWNICTWO BENTHAM SCIENCE), 27–38. Doi:10.2174/978160805078910901010027
Micheenko, A., Bzikadze •, A. V., Gurewicz, A., •, K. H., i Pevzner, P. A. (2020). TandemTools: Mapowanie długich odczytów i ocena/poprawa jakości montażu w bardzo długich powtórzeniach tandemowych. Marzec. Narkotyki 17, i75–i83. Doi:10.1093/bioinformatyka/btaa440
Momoh •, M. A., Akpa •, P. A., Ugwu •, K. C., Kenechukwu •, F. C., i Kenneth, O. C. (2020). Farmakodynamika i farmakokinetyka Zachowanie insuliny z mikrocząstek PEGylated-Mucin pokrytych polimerem wrażliwym na pH: Przygotowanie i charakterystyka. Mater. Dzisiaj Commun. 25, 101539. Doi:10.1016/j.mtcomm.2020.101539
Momoh •, M., Adedokun •, M., Adikwu •, M., i Ibezim, C. (2014). In Vitro ocena matrycy PEGylated-Mucin jako nośnika doustnego podawania chlorowodorku metforminy. Trop. J. Pharm. Res. 13, 1039–1045. Doi:10.4314/tjpr.v13i7.5
Mu •, A., Okolie •, C. O., i Agboke, A. (2008). Wpływ mucyny ślimaka na szybkość gojenia się wrzodów klarytromycyny. J. Pharm. Res. 8, 6. Doi:10.18579/jpcrkc/2009/8/1/79523
Mumuni •, M. A., Kenechukwu •, F. C., Ofokansi •, K. C., Attama •, A. A., i Díaz, D. D. (2020). Nanocząsteczki mukoadhezyjne obciążone insuliną na bazie kompleksów mucyno-chitozanowych do podawania doustnego i leczenia cukrzycy. Karbohydr. Polim. 229, 115506. Doi:10.1016/j.carbpol.2019.115506
Navarro, L. A., Francuski, D. L., i Zauscher, S. (2018). Postępy w syntezie mimiki mucyny i zastosowania w nauce o powierzchni. Curr. Opin •. Koloid Interf. Sci. 38, 122–134. Doi:10.1016/j.cocis.2018.09.004
Nguyen, J. K., Masub •, N., i Jagdeo, J. (2020). Bioaktywne składniki w koreańskich kosmeceutykach: Trendy i dowody badawcze. J. Cosmet. Dermatol. 19, 1555–1569. Doi:10.1111/jocd.13344
Park, Y. (2011). Górnictwo bezkręgowców naturalnych produktów dla przyszłego skarbu terapeutycznego. Translator adresów sieciowych. Prod. Komunia. 6 (9), 1403–1408. Doi:10.1177/1934578×1100600944
Perez-Vilar, J., i Wzgórze, R. L. (1999). Struktura i montaż wydzielanych mucyn. J. Życiorys. Chem. 274, 31751–31754. Doi:10.1074/jbc.274.45.31751
Petrou •, G., i Crouzier, T. (2018). Mucyny jako wielofunkcyjne bloki budulcowe biomateriałów. Biomater. Sci. 6, 2282–2297. Doi:10.1039/c8bm0047
Pitt, S. J., Graham, M. A., Dedi •, C. G., Taylor-Harris, P. M., i Gunn, A. (2015). Przeciwdrobnoustrojowe właściwości śluzu z brown garden snail Helix Aspersa. Br. J. Życiorys. Sci. 72, 174–181. Doi:10.1080/09674845.2015.11665749
Premi, S. (2020). Rola chemikretyzacji melaniny w progresji czerniaka i lekooporności. Front. Oncol •. 10. Doi:10.3389/fonc.2020.01305
Pushpass, R.-A. G., Pellicciotta, N., Kelly, C., Proctor, G., i Stolarz, G. H. (2019). Zmniejszone wiązanie mucyny ślinowej i glikozylacja u osób starszych wpływa na smak w In Vitro Model komórki. Składników odżywczych 11, 2280. Doi:10.3390/nu11102280
Pushpass, R. G., Daly, B., Kelly, C., Proctor, G., i Stolarz, G. H. (2019). Zmieniony przepływ śliny, Skład białka, i reologia po stymulacji smaku i TRP u osób starszych. Front. Fizjolina. 10, 652. Doi:10.3389/fphys.2019.00652
Róża, M. C., i Voynow, J. A. (2006). Geny mucyny dróg oddechowych i glikoproteiny mucyny w zdrowiu i chorobie. Fizjolina. Rev. 86, 245–278. Doi:10.1152/physrev.00010.2005
Rutkowski, P., i Kozak, K. (2017). Wiadomości z Sesji Czerniaka Europejskiego Kongresu Onkologicznego 2017. BMC Med. 15, 57. Doi:10.1186/s12916-017-0826-4
Sandberg, T., Karlsson Ott, M., Carlsson •, J., Feiler •, A., i Caldwell, K. D. (2009). Potencjalne zastosowanie mucyn jako powłok biomateriałowych. Ii. Powłoki mucynowe wpływają na konformację i właściwości aktywujące neutrofile adsorbowanych białek gospodarza - w kierunku mimiki błony śluzowej. J. Życiorys. Mater. Res. 91A, 773–785. Doi:10.1002/jbm.a.32315
Santana, W. A., Melo •, C. M. d., Cardoso •, J. C., Pereira-Filho, R. N., Rabelo •, A. S., Reis, F. P., Wsp. (2012). Ocena aktywności przeciwdrobnoustrojowej i potencjału leczniczego wydzielania śluzowego Achatina fulica. Int. J. Morfol. 30, 365–373. Doi:10.4067/s0717-95022012000200001
Sompayrac •, L. M. (2012). Jak działa układ odpornościowy. 4th Editio.
Van Putten, J. P. M., i Strijbis, K. (2017). Mucyny transbłonowe: Receptory sygnalizacyjne na przecięciu zapalenia i raka. J. Wrodzony Immun. 9, 281–299. Doi:10.1159/000453594
Van, H., Hjorth •, M., Winkeljann •, B., Dobryden, Ja., Lieleg •, O., i Crouzier, T. (2020). Modyfikacja glikomodu hydrożeli mucyny w celu zbadania ich aktywności immunologicznej. Aplikacja ACS. Mater. Między. 12, 19324–19336. Doi:10.1021/acsami.0c03645
Autorzy: Maxwell McDermott, Antoni R. Cerullo •, James Parziale, Eleonora Achrak, Sharmin Sułtanka,Jennifer Ferd, Safiyah Samad, William Deng, Adam B. Braunschweig, Mandë Holford.
 Liofilizowany śluz ślimaka Mucus pro class
1 × 1,000.00 €
Liofilizowany śluz ślimaka Mucus pro class
1 × 1,000.00 €  Mokra maska kosmetyczna MORDO
1 × 490.00 €
Mokra maska kosmetyczna MORDO
1 × 490.00 €  Liofilizowany śluz ślimaka Mucus pro class
1 × 100.00 €
Liofilizowany śluz ślimaka Mucus pro class
1 × 100.00 €  Air delivery of Mucus Pro parcels from EMS Post
1 × 30.00 €
Air delivery of Mucus Pro parcels from EMS Post
1 × 30.00 € 







