Без рубрики
ฟังก์ชั่นและการประยุกต์ใช้หอยทาก Mucins
Mucins เป็นตระกูลโปรตีนที่มี glycosylated สูงซึ่งถูกหลั่งโดยสัตว์เพื่อการยึดเกาะ, ไฮเดรชั่น, การหล่อลื่น, และฟังก์ชั่นอื่น ๆ. แม้จะแพร่หลาย, เมือกสัตว์ส่วนใหญ่ไม่เคยมีมาก่อน. หอยทากผลิตโปรตีนเมือกในเมือกเพื่อการทํางานทางชีวภาพที่หลากหลาย, รวมถึงการป้องกันจุลินทรีย์, การยึดเกาะและการหล่อลื่น. เมื่อไม่นานมานี้, เมือกหอยทากยังกลายเป็นแหล่งนวัตกรรมที่ร่ํารวยด้วยการใช้งานที่หลากหลายในวิชาเคมี, ชีววิทยา, เทคโนโลยีชีวภาพ, และชีวการแพทย์. โดย เฉพาะ อย่างยิ่ง, หอยทากถูกนํามาใช้เป็นผลิตภัณฑ์ดูแลผิว, ตัวแทนการรักษาบาดแผล, กาวผ่าตัด, และเพื่อต่อสู้กับแผลในกระเพาะอาหาร. ความก้าวหน้าล่าสุดในโอมิคส์แบบบูรณาการ (จีโนม, การถอดเสียง, โปรตีโอมิก, ไกลคอมิค) เทคโนโลยีได้ปรับปรุงลักษณะของ gastropod mucins, เพิ่มการสร้างวัสดุชีวภาพใหม่. มุมมองนี้อธิบายถึงการวิจัยในปัจจุบันเกี่ยวกับเมือกหอยทากที่หลั่งออกมา, เน้นศักยภาพของพอลิเมอร์ชีวภาพนี้, และยังสรุปกลยุทธ์การวิจัยเพื่อตอบสนองความต้องการที่ไม่ได้รับการตอบสนองในการตรวจสอบโครงสร้างลําดับชั้นที่นําไปสู่ความหลากหลายทางชีวภาพและทางเคมีมหาศาลของยีนเมือกหอยทาก.
แนะ นำ
การวางอุบายในเส้นทางเมือกเมือกที่หอยทากและทากทิ้งไว้มีอายุย้อนไปถึงกรีกโบราณ, ที่พวกเขาใช้เมือกสําหรับความสามารถในการลดการอักเสบและสัญญาณของริ้วรอย. ปัจจุบันเมือกหอยทากยังคงใช้ในผลิตภัณฑ์ดูแลผิวโดย บริษัท ต่างๆและเป็นตลาดที่กําลังเติบโตซึ่งคาดว่าจะมีมูลค่าใกล้เข้ามา $770 ล้านโดย 2025. แม้จะมีการใช้งานเชิงพาณิชย์, สาขาการวิจัยเมือกยังคงด้อยพัฒนาอย่างน่าประหลาดใจ. องค์ประกอบหลักที่รับผิดชอบต่อคุณสมบัติของเมือกคือเมือกที่หลั่งออกมา, ครอบครัวของโปรตีนไกลโคซิเลตอย่างหนักที่ผลิตในเซลล์เยื่อบุผิวในสัตว์ส่วนใหญ่. เมือกถูกผูกไว้กับเยื่อหุ้มพลาสมาหรือหลั่งออกมาจากเซลล์, และแต่ละประเภทมีความแตกต่างที่สําคัญในหน้าที่และความสามารถของพวกเขา. เมมเบรนที่ผูกกับเมมเบรนเป็นไกลโคลิพิดที่ทําหน้าที่เป็นเครื่องหมายสําหรับการส่งสัญญาณของเซลล์และยังปกป้องเซลล์จาก affronts นอกเซลล์ที่อาจนําไปสู่ความเสียหาย, เช่นการติดเชื้อและความเครียดทางกายภาพ . เมือกที่หลั่งออกมาสามารถเป็นได้ทั้งการขึ้นรูปเจลหรือพอลิเมอร์ชีวภาพที่ไม่ขึ้นรูปเจล. พอลิเมอร์ชีวภาพที่หลั่งออกมาก่อตัวเป็นเยื่อเมือกในระดับมหภาค. เยื่อเมือกเหล่านี้คิดเป็นส่วนใหญ่ของพื้นที่ผิวของสิ่งมีชีวิตหลายเซลล์ที่สัมผัสกับสิ่งแวดล้อม. ในมนุษย์, เยื่อเมือกบัญชีสําหรับ 99% ของพื้นที่ผิวของร่างกาย. หอยทากแต่ละสายพันธุ์หลั่งเมือกการทํางานที่แตกต่างกันหลายตัว. เมือกที่ผลิตโดยเท้าของหอยทากใช้สําหรับยึดเกาะและหล่อลื่น, ปล่อยให้หอยทากเกาะติดหรือเดินข้ามพื้นผิวใด ๆ, แม้ในขณะที่กลับหัว. นอกจากนี้, เมือกที่ผลิตที่ด้านหลังของหอยทากใช้สําหรับการป้องกันจุลินทรีย์และความชุ่มชื้นของเนื้อเยื่อ. หอยทากบางชนิดมีการใช้เมือกเป็นพิเศษ. เช่น, Eltanini Falsilunatia (หอยทากดวงจันทร์) ใช้เมือกเพื่อปกป้องไข่ของพวกเขา, และ เชื้อ Tikoconus costarricanus (คอสตาริกาแลนด์หอยทาก), ใช้เมือกสําหรับกิจกรรมรับน้ําหนัก, เช่น การซ่อนตัวจากดวงอาทิตย์ที่ด้านล่างของใบในช่วงฤดูแล้ง. ความก้าวหน้าล่าสุดในโอมิคส์ (จีโนม, การถอดเสียง, โปรตีโอมิก, ไกลคอมิกส์) เทคโนโลยีได้ขยายการสํารวจ gastropod mucins เป็นทรัพยากรทางวิทยาศาสตร์ที่มีการใช้งานที่หลากหลายในทางเคมี, ชีววิทยา, เทคโนโลยีชีวภาพ, และยา. เช่น, คุณสมบัติต้านจุลชีพของเมือกหอยทากถูกนํามาใช้เพื่อต่อสู้กับความผิดปกติที่พบในมนุษย์ตั้งแต่แผลในกระเพาะอาหาร, ต่อการติดเชื้อที่เกี่ยวข้องกับหลังการผ่าตัด. Mucins ยังถูกควบคู่ไปกับการรักษาที่ได้รับการรับรองเพื่อเพิ่มขีดความสามารถของยาในการรักษาโรค, เช่นโรคเบาหวานและลําไส้ใหญ่บวม ulcerative. นอกจากนี้, เมือกหอยทากกําลังถูกตรวจสอบในการใช้งานทางชีวเทคนิคอื่น ๆ อีกมากมายที่ใช้ประโยชน์จากคุณสมบัติคล้ายสารลดแรงตึงผิว . ทั้งๆ ที่ศักยภาพของพวกเขา, ไม่ค่อยมีใครรู้เกี่ยวกับโครงสร้าง mucin แบบลําดับชั้นบัญชีสําหรับคุณสมบัติการทํางานที่หลากหลายของพวกเขา. มีความจําเป็นที่ไม่ได้รับการตอบสนองในการตรวจสอบความหลากหลายทางชีวภาพและทางเคมีของยีนเมือกหอยทากเพื่ออธิบายหลักการชี้นําที่กําหนดคุณสมบัติที่หลากหลายที่เกี่ยวข้องกับยีนแต่ละตัว. บทความมุมมองนี้จะเน้นการใช้งานในปัจจุบันของเมือกหอยทากที่หลั่งออกมาซึ่งแสดงให้เห็นถึงศักยภาพของพอลิเมอร์ชีวภาพนี้เป็นทรัพยากรสําหรับความก้าวหน้าทางเทคโนโลยีชีวภาพและชีวการแพทย์. นอกจากนี้เรายังจะอธิบายกลยุทธ์โอมิคส์แบบบูรณาการสําหรับการตรวจสอบความหลากหลายทางชีวภาพและทางเคมีของยีนเมือกหอยทาก.
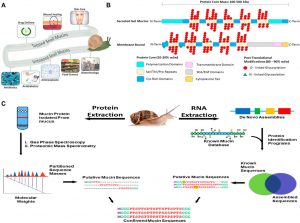
(A) การประยุกต์ใช้เมือกหอยทาก. เมือกหอยทากถูกนํามาใช้ในการดูแลผิว, สมานแผลและฟื้นฟู, และการจัดส่งยา. เมือกหอยทากกําลังถูกสํารวจในวิทยาศาสตร์การอาหาร, เคลือบรากฟันเทียม, และภาคเทคโนโลยีชีวภาพอื่น ๆ กําลังวิจัย mucins เพื่อสํารวจเพื่อนําไปใช้ประโยชน์. (B) การแสดง 2 มิติของโครงสร้างเมือก. Mucins มีลักษณะเป็นสองส่วนของโครงสร้าง, แกนโปรตีนของพวกเขา, และการแตกแขนงไกลแคน. แกนโปรตีนเป็นลําดับโปรตีนที่มีความยาวแปรผันขึ้นอยู่กับยีนเมือก, ซึ่งได้รับการแก้ไขเพิ่มเติมด้วยสาขาไกลโคซิเลชั่น. โครงสร้างโปรตีน, อย่างไรก็ตาม มีหลายโดเมน, และโดเมนเหล่านี้แตกต่างกันไปขึ้นอยู่กับฟังก์ชั่นและตําแหน่งเซลลูลาร์ของ mucin. กิ่งไกลแคนเป็นกิ่งน้ําตาลตั้งแต่ 3 ถึง 18 น้ำตาล, และประกอบขึ้นเป็นมวลเมือกส่วนใหญ่. แสดงเป็น 2 การแสดงมิติของเมือกชนิดต่าง ๆ, และคุณสมบัติแบบเหมารวม. (C) การใช้แนวทางโอมิคส์แบบบูรณาการเพื่อระบุลําดับเมือกหอยทาก, โครงสร้าง, และฟังก์ชั่น. ทาง 1(ซ้าย) สกัดโปรตีนเมือกดิบและแยกออกจากเศษเซลล์เพื่อให้ได้มวลลําดับจากการวิเคราะห์สเปกโตรสโกปีและมวลสเปกโตรมิเตอร์. ทาง 2(ขวา) การสกัด RNA จากต่อมเมือกหรือสัตว์ทั้งตัวตามด้วย De Novo การชุมนุมของลําดับยีน mucin เพื่อสร้างฐานข้อมูลเพื่อ BLAST กับการเปรียบเทียบลําดับที่ประกอบกับฐานข้อมูล mucin ที่รู้จัก, เราได้รับลําดับ mucin putative. การรวมท่อส่งโปรตีโอมิกและอาร์เอ็นเอเรายืนยันลําดับเมือกชนิดดั้งเดิมเพื่อการวิเคราะห์เพิ่มเติม.
รูปแบบโครงสร้างของ Mucins
Mucins มีหลายโดเมนที่มีส่วนช่วยในการทํางานโดยรวม. ความผันแปรของโครงสร้างช่วยให้มีความหลากหลายทางชีวภาพที่กว้างขวางและลักษณะทางกายภาพที่เป็นเอกลักษณ์. โดเมนซ้ําแบบควบคู่ที่อยู่ตรงกลางของกระดูกสันหลังของโปรตีน, อุดมไปด้วยซีรีน, ทรีโอนีน, และ proline, ทําหน้าที่เป็นจุดยึดสําหรับ glycosylation. Mucin glycans ส่วนใหญ่เชื่อมโยง O, แต่อาจมี glycans ที่เชื่อมโยง N จํานวนเล็กน้อย. ความยาวของโดเมนไกลโคซิเลชั่นและจํานวนการทําซ้ําแตกต่างกันระหว่างเมือกและให้ลักษณะทางเคมีที่แตกต่างกัน. เมือกที่หลั่งออกมามีบริเวณที่อุดมด้วยซิสเทอีนที่ปลายทั้งสองด้านของโดเมนซ้ําแบบควบคู่ที่ใช้สําหรับการรักษาเสถียรภาพ, ให้จุดสะพานซัลไฟด์สําหรับทั้งอินเตอร์- และพันธะภายในโมเลกุล. นอกจากนี้, ภูมิภาคเหล่านี้ให้บริการทั้งสองอย่างเพื่อให้เกิดความหลากหลายทางโครงสร้างเพิ่มเติม, และอนุญาตให้มีการรวมตัวของเมือกและชีวโมเลกุลที่อุดมด้วยกํามะถันอื่น ๆ .
อย่างเป็นแบบฉบับ, N-acetylgalactosamine (GalNAc) ติดอยู่กับแกนโปรตีนผ่านพันธะ O-glycosidic ระหว่าง monosaccharide และสารตกค้าง Ser หรือ Thr (GalNAc[α1]-Ser / Thr). สิ่งนี้ก่อให้เกิดแอนติเจน TN, ซึ่งพบได้ทั่วไปในมนุษย์ที่มีการควบคุมในมะเร็งบางชนิด . จากที่นั่น, กาแลคโตสถูกผนวกเข้ากับโครงสร้าง (กัล[β1-3]GalNAc[α1]-Ser / Thr), สร้างแกนเมือก 1 โอ-ไกลแคน. O-glycans มีขนาดแตกต่างกัน, จาก 2 ถึง 20 น้ําตาลตกค้าง, และในองค์ประกอบ, เช่นเดียวกับน้ําตาลอื่น ๆ เช่น N-acetylglucosamine (GlcNAc) และ fucose (ฟุค) ถูกผนวกตามลําดับ. กรดเซียลิกและแมนโนสยังพบในปริมาณเล็กน้อย. โดยเฉพาะกรดเซียลิก, เป็นที่ทราบกันดีว่ามีบทบาทสําคัญในคุณสมบัติภูมิคุ้มกันของเมือก. กรดเซียลิกเป็นสื่อกลางปฏิกิริยาระหว่างเซลล์กับเซลล์, พร้อมกับความสามารถในการปกปิดแอนติเจนจากแมคโครฟาจของมนุษย์ . เลย, กรดเซียลิกเป็นจุดยึดเกาะที่สําคัญสําหรับเลคติน, ตระกูลโปรตีนทั่วไปที่พบในระบบภูมิคุ้มกันโดยธรรมชาติ. นอกจากนี้, mucins หลั่งยังแสดง C-mannosylation, โดยที่ C1 ของ mannose ยึดติดกับวงแหวนอินโดลในทริปโตเฟน, ช่วยให้มีการเปลี่ยนแปลงโครงสร้างระดับอุดมศึกษามากขึ้น .
การเปลี่ยนแปลงที่ละเอียดอ่อนภายในโครงสร้างเมือก, โดยเฉพาะอย่างยิ่งลําดับกรดอะมิโนและไกลโคซิเลชั่น, สามารถสอดคล้องกับฟังก์ชั่นทางชีวภาพที่แตกต่างกันอย่างมากมาย . ในขณะที่โปรตีนเหล่านี้ส่วนใหญ่เป็นคาร์โบไฮเดรตโดยน้ําหนัก, สูงสุด 90%, ทั้งโครงสร้างโปรตีนและไกลแคนให้ลักษณะการทํางานโดยรวมแก่เมือก. นอกจากนี้, เมือกแต่ละตัวสามารถมีไกลโคฟอร์มได้หลายแบบในสภาวะปกติและเป็นโรค, และประชากรที่แตกต่างกันของสปีชีส์เดียวสามารถแสดงไกลโคฟอร์มที่แตกต่างกัน. ความหลากหลายนี้ช่วยให้สิ่งมีชีวิตสามารถแยกเมือกแต่ละตัวสําหรับสภาพทางสรีรวิทยาและสิ่งแวดล้อมที่เฉพาะเจาะจง. โดยรวมแล้วไม่ค่อยมีใครรู้เกี่ยวกับการเชื่อมต่อจีโนไทป์กับฟีโนไทป์ของยีนเมือกที่นําไปสู่คุณสมบัติการทํางานต่างๆ. มีการระบุยีนเมือกของมนุษย์หลายตัวและมีอย่างน้อย 21 ยีนเข้ารหัส Mucin ที่ผ่านการตรวจสอบแล้ว, แต่ละคนมีกิจกรรมทางชีวภาพที่แตกต่างกัน. ในทางตรงกันข้าม, ในขณะที่ยีนเมือกหอยทากจํานวนมากได้รับการระบุไม่มีการตรวจสอบ. อย่างไรก็ตาม, การขาดลักษณะที่แข็งแกร่งของพันธุศาสตร์และความแตกต่างทางโครงสร้างระหว่างเมือกหอยทากไม่ได้ขัดขวางการประยุกต์ใช้เพื่อตอบสนองความต้องการวัสดุทางการแพทย์และเทคโนโลยีชีวภาพที่เร่งด่วน.
หอยทาก Mucins เป็นตัวแทนต้านจุลชีพ
แบคทีเรียที่ดื้อยาปฏิชีวนะกําลังกลายเป็นปัญหาที่แพร่หลายมากขึ้นโดยไม่มีวิธีแก้ปัญหาที่เป็นไปได้มากมาย. เพราะหอยขาดภูมิคุ้มกันแบบปรับตัว, พวกเขาขึ้นอยู่กับอุปสรรคทางกายภาพและภูมิคุ้มกันโดยธรรมชาติสําหรับการป้องกันตัวแทนที่ทําให้เกิดโรค. สําหรับหอยทากส่วนใหญ่, เท้าสัมผัสกับพื้นผิวที่ปนเปื้อนเชื้อโรคและปรสิตมากที่สุด, และการหลั่งเมือกตามเท้าช่วยป้องกันจุลินทรีย์ดังกล่าว. หนึ่งในเมือกแรกสุดที่ประเมินฤทธิ์ต้านจุลชีพคือ Achatina fulica (หอยทากยักษ์แอฟริกา). เมือกจาก A. ฟูลิกา แสดงให้เห็นถึงกิจกรรมต้านเชื้อแบคทีเรียที่มีแนวโน้มต่อต้านแบคทีเรียแกรมบวก, บาซิลลัสซับทิลิส และ เชื้อ Staphylococcus aureus, และแบคทีเรียแกรมลบ, เชื้อ Escherichia coli และ Aeruginosa Pseudomonas . การหลั่งเมือกของ A. ฟูลิกา ยับยั้งการเจริญเติบโตของแบคทีเรียทั้งสอง S. ออเรียส และ S. เอพิเดอร์มิดิส เมื่อใช้ผ่านฟิล์มแผลบนเมาส์รุ่น. แผลพุพองช่วยเพิ่มการเจริญเติบโตของเนื้อเยื่อแกรนูลและอัตราการสะสมของคอลลาเจน, ซึ่งเป็นที่ทราบกันดีว่าเร่งกระบวนการบําบัด . ในการศึกษาที่คล้ายกัน, เมือกของ Helix aspersa แสดงให้เห็นถึงฤทธิ์ต้านจุลชีพต่อหลายสายพันธุ์ของ Aeruginosa Pseudomonas. เลย, เมือกของทั้งสอง A. มาร์จิ้นินาต้า และ A. ฟูลิกา, ถูกใช้เป็นแผล dressinsg บน 28 ตัวอย่างบาดแผลทางคลินิกที่เก็บรวบรวมด้วยการติดเชื้อทั่วไปที่รู้จัก. เมือกแสดงฤทธิ์ต้านแบคทีเรียต่อ เชื้อ Staphylococcus, สเตรปโทคอกคัส, และ ซูโดโมนาส แยกจากบาดแผล. ในการศึกษาเดียวกัน, เมื่อเปรียบเทียบกับยาปฏิชีวนะทั่วไปเจ็ดชนิด, รวมทั้ง amoxicillin, สเตรปโตมัยซิน, และ chloramphenicol, สารคัดหลั่งเมือกบางส่วนยับยั้งการติดเชื้อได้มากกว่ายาปฏิชีวนะเชิงพาณิชย์. การทําความเข้าใจคุณสมบัติต้านจุลชีพของเมือกหอยทากเป็นพื้นที่ที่ใช้งานและเติบโตของการวิจัย.
สายพันธุ์ Mollusca ที่มีการใช้เมือกในภาคส่วนต่าง ๆ สําหรับการใช้งานด้านชีวการแพทย์หรือเทคโนโลยีชีวภาพ. เมือกหอยที่ใช้เป็นยาต้านจุลชีพเพื่อยับยั้งเชื้อโรค.
หอยทาก Mucins เป็นยานพาหนะจัดส่งยา
ความสามารถในการปรับตัวของพอลิเมอร์เมือกหอยทากทําให้พวกเขามีแนวโน้มที่ไม่เหมือนใครสําหรับระบบการจัดส่งยาใหม่. ระหว่างการผสมพันธุ์, หอยทากตัวผู้ยิงลูกดอกเพื่อส่งเมือกที่มีโปรตีนเสริมเข้าไปในตัวเมีย, ซึ่งจะเพิ่มความอุดมสมบูรณ์ของหอยทากตัวเมีย . กระบวนการนี้อาศัยระบบมัลติฟังก์ชั่น, โดยแต่ละองค์ประกอบมีบทบาทที่กําหนดไว้. โผทําหน้าที่เป็นเข็ม, เจาะเนื้อเยื่อและฉีดเมือกที่นําโปรตีนเสริมเข้าไปในหอยทากตัวเมีย. ในลักษณะเดียวกัน, เมือกสามารถดัดแปลงเพื่อทําหน้าที่เป็นเวกเตอร์นําส่งสําหรับโมเลกุลที่ออกฤทธิ์ทางชีวภาพ. เมือกหอยทากเป็นที่ทราบกันดีว่าเข้ากันได้ดีกับยาใด ๆ ที่ดูดซึมผ่านเยื่อเมือกเนื่องจากความสามารถในการแพร่กระจายไปทั่วเยื่อหุ้มเซลล์ . เช่น, เมตฟอร์มินไฮโดรคลอไรด์, ยารักษาโรคเบาหวาน, ติดอยู่กับเมือกหอยทากยักษ์แอฟริกันแลนด์โดยใช้โพลีเอทิลีนไกลคอล (หมุด) เพื่อเพิ่มการดูดซึมของยาเสพติด. PEGylation, เป็นกระบวนการที่ใช้กันทั่วไปซึ่งการรักษาถูกล้อมรอบด้วยเมทริกซ์ของโพลีเมอร์เป็นหลัก, โพลีเอทิลีนไกลคอล. เมทริกซ์นี้มีผลต่อเภสัชจลนศาสตร์ของการรักษา, ยืดครึ่งชีวิต, ผ่านการป้องกันจากแอนติบอดี, และช่วยให้สามารถควบคุมการกระจายทางชีวภาพได้หลากหลายขึ้นอยู่กับองค์ประกอบของเมทริกซ์. เมือกหอยทากโดยเฉพาะแสดงให้เห็นถึงคํามั่นสัญญาว่าเป็นพอลิเมอร์, เนื่องจากเป็นพวกที่ชอบน้ํามาก, และยังทําปฏิกิริยากับเยื่อเมือกทางเดินอาหารได้อย่างง่ายดาย, ตําแหน่งการดูดซึมยาทั่วไป. Metformin-loaded PEGylated-mucin ปรับปรุงเภสัชจลนศาสตร์และเภสัชพลศาสตร์ของยาที่ดูดซึมได้ไม่ดีตามปกติ, เพิ่มการปล่อยไปยัง 92% เมื่อเทียบกับ 81% ปัจจุบันใช้ในตลาด. ในแอปพลิเคชันอื่น, สรรพ Costus afer (ขิงลิลลี่) ดอกไม้รวมกับเมือกหอยทากพบว่าระดับน้ําตาลในเลือดในผู้ป่วยโรคเบาหวานลดลง กล้ามเนื้อ (หนูเผือกสวิส) ในแบบที่ขึ้นอยู่กับปริมาณ, ซึ่งแสดงให้เห็นถึงศักยภาพในการต้านโรคเบาหวานที่เป็นไปได้ของเมือกหอยทาก.
เมทริกซ์พอลิเมอร์ที่จับกับยาและผลึกวาเทอไรต์ที่มีส่วนผสมของเมือกถูกใช้เป็นพาหะนําส่งยาสําหรับการโหลดและควบคุมการปล่อยยาต้านมะเร็งขนาดเล็กและการบําบัดด้วยโปรตีนอย่างมีประสิทธิภาพ. ไมโครคริสตัลวาเทอไรต์, เมื่อตกผลึกในความเข้มข้นของเมือกตั้งแต่ 1 และ 6 มก./มล., มีการเก็บรักษาที่ดีขึ้นของกิจกรรมทางชีวภาพประจุบวกและความเสถียรในสภาพทางสรีรวิทยานอกจากนี้, Mucins ได้รับการจับคู่กับสารไวแสงเพื่อเพิ่มการกําหนดเป้าหมายและเพิ่มประสิทธิภาพการควบคุมการส่งผ่านไปยังเซลล์มะเร็ง. แคปซูลหลายชั้นของเมือกที่ประกอบขึ้นเองและอนุภาคขนาดเล็กที่มีส่วนผสมของเมือกเป็นที่สนใจเป็นพิเศษสําหรับการศึกษาในอนาคตเกี่ยวกับกลไกการส่งยาควบคุมการปลดปล่อย, โดยเฉพาะอย่างยิ่งเพื่อเอาชนะความท้าทายของความเข้ากันได้ทางชีวภาพ, ความสามารถในการย่อยสลายทางชีวภาพ, และ mucoadhesion.
หอยทาก Mucins เป็นตัวแทนต่อต้านเนื้องอก
เมือกหอยทากได้แสดงศักยภาพในการรักษามะเร็งผิวหนัง, หนึ่งในมะเร็งผิวหนังที่อันตรายที่สุด. ในขณะที่การพัฒนาใหม่ในการรักษาโรคมะเร็งส่งผลให้อัตราการให้อภัยมากขึ้นและอายุขัยยืนยาวขึ้นสําหรับผู้ที่ทุกข์ทรมาน, การพัฒนาเหล่านี้ไม่ได้แสดงผลผลิตที่คล้ายกันสําหรับเนื้องอก. เนื่องจากความต้านทานการรักษาเป็นเรื่องปกติสําหรับมะเร็งชนิดนี้, มีความจําเป็นเร่งด่วนในการค้นหาแนวทางใหม่ที่มีประสิทธิภาพในการรักษามะเร็งผิวหนัง. การศึกษาของ H. อาเปอร์ซา เมือกบนสายเซลล์มะเร็งผิวหนังรายงานว่าเมือกหอยทากลดความมีชีวิตและยับยั้งการแพร่กระจายของเซลล์มะเร็งผิวหนัง. การลดลงของความมีชีวิตของเซลล์เกิดจากเหตุการณ์ apoptotic ที่เกี่ยวข้องกับความแตกแยกของโพลี (ADP-ไรโบส) พอลิเมอเรส (ปารป). นอกจากนี้การยับยั้งการแพร่กระจายยังทําได้โดยการปิดกั้นฟังก์ชันและการแสดงออกของ integrin, และยับยั้งมะเร็งไม่ให้สามารถเติบโตได้. ในการศึกษาอื่น, H. แอสเปอร์ซา Mucin ยับยั้งการเจริญเติบโตของเซลล์มะเร็งผิวหนังของมนุษย์สองสายโดยตรง, โดยการเพิ่มการแสดงออกของไซโตไคน์ TNFα, และยับยั้ง NF-κB, กระบวนการถอดความที่ในการควบคุมที่เหมาะสมเชื่อมโยงกับการลุกลามของมะเร็ง, การเจริญเติบโตของสายเซลล์เหล่านี้ลดลง, แสดงให้เห็นถึงคุณสมบัติต่อต้านเมลาโนเจน. ในขณะที่ยังอยู่ในช่วงเริ่มต้นของการพัฒนา, การใช้เมือกหอยทากเป็นตัวแทนต่อต้านเนื้องอกเป็นที่สนใจเพิ่มขึ้นในชุมชนชีวการแพทย์.
หอยทาก Mucins อํานวยความสะดวกในการรักษาบาดแผล
เมือกหอยทากสามารถอํานวยความสะดวกในการรักษาและกลายเป็นทรัพยากรสําคัญในการวิจัยบาดแผล. Mucins จาก Helix aspersa (หอยทากสวน) ได้รับการแสดงเพื่อช่วยในการฟื้นฟูผิวหลังจาก radiodermatitis เฉียบพลัน, ผลข้างเคียงที่พบบ่อยจากการฉายรังสี. มีรายงานว่าเมือกหอยทากในสวนเพิ่มอัตราการรักษาผ่านสารต้านอนุมูลอิสระและการควบคุมอนุมูลอิสระ. เมือกจากสวนปรับปรุงผื่นแดงในแบบจําลองหนู, และ, หนูตัวเดียวกันแสดงการลดลงของการถ่ายภาพเช่นกัน. ตลอดจนสามารถรักษาอาการบาดเจ็บผิวเผินได้, Mucins ได้แสดงให้เห็นถึงความสามารถในการใช้กับบาดแผลภายใน. Mucins ถูกรวมเข้าด้วยกันพร้อมกับยาต้านการอักเสบที่ไม่ใช่สเตียรอยด์ในช่องปาก (NSAIDs), เพื่อลดหรือกําจัดการบาดเจ็บของเยื่อเมือกในกระเพาะอาหาร. NSAIDs ลดการอักเสบ, แต่มีผลข้างเคียงที่ไม่พึงประสงค์ที่เกี่ยวข้องกับการบาดเจ็บทางเดินอาหารและความเสียหายของตับ. หลาย บริษัท ได้หันไปใช้ผลิตภัณฑ์จากธรรมชาติเพื่อต่อต้านผลข้างเคียงเหล่านี้, และ Mucin ได้รับการแสดงเพื่อรักษาแผลในกระเพาะอาหาร, ผลข้างเคียงที่เกิดจาก NSAIDs. การรวมกันของยาปฏิชีวนะ, คลาริโทรมัยซิน, และ A. ฟูลิกา Mucin ได้แสดงผลลัพธ์ในเชิงบวกในการรักษาโรคแผลในกระเพาะอาหาร. นอกจากคุณสมบัติต้านแผลในกระเพาะอาหารแล้ว, อัตราการรักษาแผลเพิ่มขึ้นตามความเข้มข้นของเมือกและเร็วกว่า clarithromycin เพียงอย่างเดียว.
เมือกหอยทากที่ใช้สําหรับวัสดุชีวภาพ
การศึกษาสารที่เกิดขึ้นตามธรรมชาติเป็นแพลตฟอร์มในการสร้างวัสดุใหม่ส่งผลให้เกิดการปฏิวัติผลิตภัณฑ์หลายอย่าง, เช่น Lipitor, เพนิซิลิน, และมอร์ฟีน. เช่นเดียวกัน, Mucins ถูกใช้เป็นสารเคลือบวัสดุชีวภาพเพื่อลดการปฏิเสธการปลูกถ่ายอนินทรีย์. การปฏิเสธการผ่าตัดรากฟันเทียมเนื่องจากการติดเชื้อส่งผลให้มากกว่า 1 ล้านกรณีทางการแพทย์ต่อปีโดยค่าใช้จ่ายของการผ่าตัดเดิมเป็นเพียงเศษเสี้ยวของค่าใช้จ่ายในการรักษาการติดเชื้อที่เกี่ยวข้อง. การใช้ฟิล์มเมือกกับโพลีเอทิลีนเทเรฟทาเลต, วัสดุทั่วไปที่ใช้ในรากฟันเทียมทางการแพทย์, ลดการตอบสนองของภูมิคุ้มกันที่เกิดจากการดูดซึม IgG และ IgM ลงในพลาสติกได้อย่างมาก. การศึกษาเดียวกันยังแสดงให้เห็นว่ามันลดการกระตุ้นของไฟบริโนเจน, สารอักเสบที่รู้จัก, เมื่อสัมผัสกับสารเคลือบเมือกเมื่อเทียบกับพลาสติกที่ไม่เคลือบผิว. เมือกได้รับการแสดงในการศึกษาอื่น ๆ เพื่อลดการสืบพันธุ์ของจุลินทรีย์บนอุปกรณ์ที่ฝัง. เทคโนโลยีที่ใช้ Mucin แสดงให้เห็นถึงคํามั่นสัญญาอันยิ่งใหญ่สําหรับความก้าวหน้าในด้านวัสดุชีวภาพ.
ตัวอย่างของเมือกที่ใช้เป็นวัสดุชีวภาพคือการใช้เมือกในการสังเคราะห์ไฮโดรคาร์บอนที่ละลายน้ําได้. โดยการแยกเมือกและ/หรือสารประกอบเลียนแบบเมือกด้วยห่วงโซ่ไขมันที่ไม่ชอบน้ํา, ไฮโดรคาร์บอนคอมเพล็กซ์ยังคงแขวนลอยอยู่ในสภาพน้ํา, แม้หลังจากผ่านไปหลายเดือน, ในขณะที่ไฮโดรคาร์บอนที่ไม่ซับซ้อนจะตกตะกอนอย่างรวดเร็วจากสารละลาย. ในการศึกษาอื่นที่เกี่ยวข้องดําเนินการโดยกลุ่มของ Combaa, คุณสมบัตินี้ถูกนําไปใช้เพื่อเพิ่มการตรวจจับกลูโคสโดยการสร้างสารแขวนลอยที่เสถียรของคอมเพล็กซ์ท่อนาโนคาร์บอน - เมือกสําหรับไบโอเซนเซอร์กลูโคสชนิดแซนวิช. อุปกรณ์วิเคราะห์ทางชีวภาพที่ได้คือ 20% มีความละเอียดอ่อนมากขึ้นและ 40% เร็วกว่าอุปกรณ์ทั่วไปที่ไม่มีเมทริกซ์การออกแบบเซ็นเซอร์นี้.
มูซินส์, ซึ่งสัมผัสกับยาที่ดูดซึมผ่านเยื่อเมือก, นอกจากนี้ยังสามารถใช้ในโครมาโตกราฟีเพื่อช่วยในการกําหนดการดูดซึมและการดูดซึมผ่านเมมเบรน. เมือกในกระเพาะอาหารหมู, ผูกติดกับคอลัมน์ซิลิกาผ่านตัวเชื่อมโยงอะมิโนโพรพิล, อนุญาตให้แยกโมเลกุลของยาโดยความสัมพันธ์ที่จับเยื่อเมือกของยา. ในการศึกษาอื่น mucin ถูกยึดไว้กับคอลัมน์โดยใช้การแลกเปลี่ยนไอออนกับแคลเซียมอัลจิเนต, เมือกถูกตรึงไว้, เลียนแบบเยื่อเมือกชีวภาพ. ระยะเวลาการเก็บรักษาของโมเลกุลภายในคอลัมน์เมือกนานขึ้นบ่งชี้ว่ามีปฏิสัมพันธ์ระหว่างยากับเมือกสูง, ซึ่งมีความสัมพันธ์กับการดูดซึมที่ล่าช้าในร่างกาย. นี่เป็นการเพิ่มอีกมิติหนึ่งในการประเมินยาที่ใช้ในโรคเฉพาะที่มีผลต่อการผลิตเมือก, เช่น โรคปอดเรื้อรัง.
คอลัมน์เมือกในกระเพาะอาหารหมูชนิดเดียวกันถูกนํามาใช้เพื่อประเมินการกักเก็บรสชาติโดยอุตสาหกรรมอาหาร. คอลัมน์เมือกถูกแสดงเพื่อเลียนแบบลิ้นวัวเพื่อกักเก็บรสชาติ, ซึ่งช่วยลดความต้องการและอาจกําจัดการทดลองในสัตว์ได้. Mucins ได้รับการศึกษาอย่างกว้างขวางในบทบาทของพวกเขาด้วยการรับรู้รสชาติ. การปรากฏตัวของ mucins ภายในช่องปากมีความสัมพันธ์โดยตรงกับการตกตะกอนที่เพิ่มขึ้นของสารประกอบที่ผลิตรสชาติ, ซึ่งจะเพิ่มการรับรู้รสชาติ. ปรากฏการณ์นี้กําลังถูกตรวจสอบว่าเป็นสาเหตุของการสูญเสียรสชาติในวัยชรา. ระดับที่ลดลงของ MUC7 ในน้ําลายได้รับการบันทึกในผู้สูงอายุรสชาติลดลง. การลดขนาดนี้เชื่อว่าจะช่วยลดการยึดเกาะของโมเลกุลรสชาติ, นําไปสู่การรับรู้รสชาติที่ลดลง.
ก้าวของหอยทากในการจําแนกลักษณะของโมเลกุลเมือก
แม้จะมีความสนใจในสาขานี้เพิ่มขึ้น, ยังมีอุปสรรคมากมายที่ขัดขวางความก้าวหน้าในการวิจัยเมือกหอยทาก. หอยทากหลายสายพันธุ์ที่มีศักยภาพในการค้นพบเมือกใหม่มักไม่สามารถเข้าถึงได้เนื่องจากที่อยู่อาศัยของพวกมัน. การขาดตัวอย่างวัสดุชีวภาพที่เข้าถึงได้ง่ายและความยากลําบากในการระบุโครงสร้างเมือกป้องกันการสังเคราะห์เมือกที่เชื่อถือได้ในปริมาณที่เพียงพอสําหรับการทดลองซ้ํา. หลายกลุ่มกําลังตรวจสอบความยั่งยืน, แนวทางที่ปรับขนาดได้ในการผลิตเมือกสังเคราะห์, อย่างไรก็ตามสนามอยู่ในวัยเด็กในขณะที่ mucins ที่ถูกแยกออกจาก A. ฟูลิกา ได้รับการศึกษาอย่างกว้างขวาง, สายพันธุ์อื่น ๆ ยังคงถูกทอดทิ้ง.
วิธีที่เป็นไปได้มากที่สุดสําหรับการผลิตเมือกเชิงพาณิชย์ยังคงเป็นการสกัดและแยกออกจากสัตว์, ซึ่งไม่อนุญาตให้มีผลผลิตจํานวนมากสําหรับการใช้งานโดยไม่มีทุนสัตว์มากมายและโดยทั่วไปเกี่ยวข้องกับวิธีการรุกราน. ความซับซ้อน, ความอุดมสมบูรณ์, และการแปลรูปแบบไกลโคซิเลชั่นในแต่ละเมือก, นอกจากเมือกไกลโคฟอร์มต่างๆแล้วยังทําให้เกิดความยากลําบากในการใช้วิธีการแยกทั่วไปเพื่อชําระล้าง, สังเคราะห์, และวิเคราะห์ตัวอย่างเมือก. Mucins มักจะได้รับการดัดแปลงหลังการแปล, เช่น O-sulfation, เอ็น-ซัลเฟต, และ N-deacetylation ที่แยกการทํางานระหว่างโปรตีน. การปรับเปลี่ยนไกลแคนหลังการแปลเหล่านี้เป็นอุปสรรคต่อการทําให้บริสุทธิ์ตัวอย่างเมือก, ลักษณะเฉพาะ, และการสังเคราะห์. วิธีการสังเคราะห์ที่มีแนวโน้มเกี่ยวข้องกับการใช้แบคทีเรีย recombinant, ไกลโคซิลทรานสเฟอเรส(จีที)-พอลิเมอไรเซชันไกล่เกลี่ย, และทรานส์ไกลโคซิเลชั่น. อย่างไรก็ตาม, วิธีการเหล่านี้ไม่เพียงพอที่จะบรรลุผลผลิตในทางปฏิบัติทางอุตสาหกรรมและจะล้มเหลวในการสร้างชุดไกลโคฟอร์มที่ละเอียดถี่ถ้วนซึ่งประกอบด้วยเจลเมือกธรรมชาติ. ยังมีความยากลําบากในการสร้าง O–glycosylation ในยีสต์, และมีความท้าทายในการถ่ายโอนสาขาไกลโคซิเลชั่นไปยังโปรตีนตกค้างที่เลือก. ปัญหาเหล่านี้นําเสนอความจําเป็นในการพัฒนาวิธีการที่มีศักยภาพและให้ผลผลิตสูงสําหรับการสังเคราะห์เมือกโดยใช้เคมีที่ปรับขนาดได้, ซึ่งจะเป็นขั้นตอนแรกในการใช้ mucins เป็นการรักษาหรือการรักษาแบบกําหนดเป้าหมาย.
ปีที่ผ่านมาได้เห็นการเกิดขึ้นของเทคโนโลยี -omic (จีโนมิกส์, ทรานสคริปโทมิกส์, โปรตีโอมิกส์, ไกลคอมิกส์) ที่ต้องการตัวอย่างในปริมาณที่น้อยที่สุด, อนุญาตให้มีการกําหนดลักษณะของตัวอย่างหอยทากที่หายากหรือเข้าถึงได้ไม่ดี. กลยุทธ์ที่คล้ายกับสิ่งที่ทํากับพิษหอยทากโดยใช้พิษ, ซึ่งจับคู่วิธีการถอดเสียงและโปรตีโอมิกกับ De Novo โปรแกรมการประกอบชีวสารสนเทศลําดับเพื่อระบุโครงสร้างทางพันธุกรรมของพิษหอยทาก putative peptide toxins, สามารถนําไปใช้เพื่อกําหนดลักษณะยีนเมือกและโปรตีนเมือก. โดย เฉพาะ อย่างยิ่ง, โดยการนําลําดับนิวคลีโอไทด์ของเอ็กโซมที่ประกอบขึ้น, แล้วจับคู่กับค่ามวลโปรตีโอมิก, เราสามารถยืนยันโครงสร้างโปรตีนเมือกเชิงเส้น. ในวิธีนี้เราสกัด mRNA จากต่อมเมือกหรือสัตว์ทั้งตัวและผ่านท่อส่งชีวสารสนเทศ, ระบุยีนเมือกและลําดับโปรตีนเมือกปฐมภูมิ. ความคิดริเริ่มใหม่, โครงการ Mucomics สัตว์เปรียบเทียบ (ค่าย) จะใช้การวิเคราะห์เปรียบเทียบอย่างเป็นระบบของยีนเมือกและเมือกไฮโดรเจลเพื่อกําหนดโครงสร้างลําดับชั้นและคุณสมบัติของเมือกที่แตกต่างกัน.
แม้จะมีคํามั่นสัญญาว่าจะใช้วิธีการโอมิคในการผลิตฐานข้อมูลที่แข็งแกร่งของมิวซิน, อุปสรรคสําคัญยังคงอยู่สําหรับการศึกษาของพวกเขา. อุปสรรคอย่างหนึ่งคืออัลกอริทึมที่ใช้ในการประกอบยีนลําดับ. กราฟ De Bruijn, ซึ่งเป็นลําดับอัลกอริทึมที่แอสเซมเบลอร์ส่วนใหญ่ใช้, มีปัญหาในการแมปโดเมนที่ซ้ํากันเนื่องจากความหลากหลายของลําดับที่ทับซ้อนกันที่คล้ายกัน. ขณะนี้มีการพัฒนาเครื่องมือหลายอย่างเพื่อเอาชนะปัญหานี้ . แต่ละโปรแกรมจะเปลี่ยนการถ่วงน้ําหนักของ k-mers ที่ใช้ในการสร้างกราฟ De Bruijn เพื่อรองรับการทําซ้ําแบบตีคู่. สําหรับการศึกษาโปรตีโอมิกเมือก, ปฏิสัมพันธ์ระหว่างโมเลกุลของเมือกกับเมือกอื่น ๆ ทําให้เกิดความยากลําบากในระดับเพิ่มเติม. Mucins ตามธรรมชาติจะสร้างมัลติเมอร์ของตัวเอง, เชื่อมต่อโปรตีนหลายตัวเข้าด้วยกันเพื่อสร้างโครงสร้างที่ใหญ่ขึ้น, ซึ่งสังเกตได้เป็นประจําในธรรมชาติ. เพื่อให้ได้โปรตีนตัวเดียว, พันธะร่วมต้องถูกทําลาย, โดยไม่ทําลายพันธะของโปรตีนตัวเดียว. อย่างไรก็ตาม, พันธะหลายตัวของเมือกนั้นยากที่จะลดโดยไม่มีผลต่อส่วนที่เหลือของโครงสร้างทุติยภูมิของห่วงโซ่เมือกเดี่ยว. ปัจจุบันมีการใช้ขั้นตอนการลองผิดลองถูกในการศึกษาโปรตีโอมิกของเมือกเพื่อสร้างมวลโปรตีนเดี่ยว. จะต้องสร้างลักษณะเฉพาะและเทคนิคการสังเคราะห์ใหม่เพื่อระบุและประดิษฐ์เมือกหอยทากอย่างถูกต้อง, และด้วยวิธีการโอมิคส์เราอาจสามารถกําหนดจีโนไทป์เพื่อทําแผนที่ฟีโนไทป์ที่จําเป็นในการทําความเข้าใจและถอดรหัสความแตกต่างของฟังก์ชันที่พบในตัวอย่างเมือกแต่ละตัวอย่าง.
สรุปข้อสังเกตและมุมมองในอนาคต
หอยทากพบได้ในเกือบทุกไบโอม, และสภาพแวดล้อมดูเหมือนจะขับเคลื่อนความหลากหลายของยีนเมือกและความเก่งกาจของการทํางานของเมือก. เมือกหอยทากได้แสดงให้เห็นถึงศักยภาพทางชีวการแพทย์และเทคโนโลยีชีวภาพ, และเป็นทรัพยากรชีวภาพของสัญญาที่สําคัญ. ลักษณะของเมือกหอยทากไม่ได้ถูก จํากัด ด้วยคุณค่าโดยธรรมชาติ, แต่โดยการเข้าถึงและความซับซ้อนของการระบุโมเลกุล, การทําให้บริสุทธิ์และการตรวจสอบ. ยังมีคําถามอีกหลายข้อที่ต้องตอบเกี่ยวกับคุณสมบัติของเมือกและเมือกที่เกี่ยวข้องกับการใช้งานที่เกี่ยวข้อง. อนาคตนี้แสดงให้เห็นถึงศักยภาพในการให้ผลผลิตสูงของเมือกหอยทาก, และโดยการใช้ไปป์ไลน์ Omics เปรียบเทียบที่ปรับเปลี่ยนได้, เราสามารถเข้าใจโปรตีนที่เป็นเอกลักษณ์เหล่านี้ได้ดีขึ้น, และคุณสมบัติทางชีวภาพและทางเคมีที่ได้เปรียบ.
อ้าง อิง: อับดุลลา, A., อดัมส์, N., กระดูก, M., เอลเลียต, A. M., แกฟฟิน, J., โจนส์, D., et al. (2013). คําแนะนําเกี่ยวกับการจัดการความเจ็บปวดในผู้สูงอายุ. อายุผู้สูงวัย 42, ไอ 1–ไอ 57. ดอย:10.1093/สูงวัย/AFS200
อับดุลลาห์, L. H., โคคลีย์, R., เว็บสเตอร์, M. J., จู้, Y., ทาร์แรน, R., ราดิซิโอนี, G., et al. (2018). การผลิต Mucin และการตอบสนองต่อความชุ่มชื้นต่อวัสดุ Mucopurulent ในเยื่อบุผิวทางเดินหายใจแบบปกติเทียบกับ Cystic Fibrosis Airway Epithelia. น.. J. เรสไปร์. คริต. ดูแล Med. 197, 481–491. ดอย:10.1164/RCCM.201706-1139OC
กุจิ, S. M. M., ไอคาวะ, T., และมัตสึโมโต้, J. J. (1982). ฤทธิ์ต้านเชื้อแบคทีเรียของหอยทากเมือก Mucin. คอมพ์. ชีวเคมี. ฟิสิออล. A: ฟิสิออล. 72, 571–574. ดอย:10.1016/0300-9629(82)90123-2
โลดิ, M., Staikou, A., แจนส์เซ่น, R., และ Koene, J. M. (2017). การแข่งขันสเปิร์มระดับสูงอาจเพิ่มการถ่ายโอนผลิตภัณฑ์ต่อมอุปกรณ์เสริมที่ดําเนินการโดยโผรักของหอยทากบก. อีโคล. เอโวล. 7, 11148–11156. ดอย:10.1002/อีซี 3.3385
แม่, J., รูบิน, B. K., และ Voynow, J. A. (2018). มูซินส์, เมือก, และ Goblet Cells. อก 154, 169–176. ดอย:10.1016/j.chest.2017.11.008
มาร์ตินส์, M. D. F., กาเอตาโน, F. A. M., Sírio, O. J., Yiomasa, M. M., มิซุซากิ, C. ผม, และ Figueiredo, L. D. (2003). Avaliação macro microscópica da cicatrização de lesões experimentalmente provocadas em pele de coelhos tratadas com secreção mucoglicoproteica Do escargot Achatina fulica. บราซ. J. สัตวแพทย์. เรส. อนิม. วิทย์. 40, 213. ดอย:10.1590/ส 1413-95962003000900009
A. ไมเคิล (บรรณาธิการ) (2012). "ศักยภาพที่หลากหลายของพอลิเมอร์ชีวภาพที่ได้จากสัตว์เขตร้อนในการจัดส่งยา: บทเรียนจากเมือกหอยทากแอฟริกัน," พอลิเมอร์ชีวภาพในการจัดส่งยา: ความก้าวหน้าและความท้าทายล่าสุด (ชาร์จาห์, ยูเออี: สํานักพิมพ์วิทยาศาสตร์เบนแธม), 27–38. ดอย:10.2174/978160805078910901010027
มิคเฮนโก, A., Bzikadze, A. V., กูเรวิช, A., Miga, K. H., และ Pevzner, P. A. (2020). Tandem เครื่องมือ: การทําแผนที่การอ่านแบบยาวและการประเมิน/ปรับปรุงคุณภาพการประกอบในการทําซ้ําแบบตีคู่ที่ยาวเป็นพิเศษ. มี.ค.. ยา เสพ ติด 17, ไอ 75–ไอ 83. ดอย:10.1093/ชีวสารสนเทศศาสตร์/BTAA440
โมโมห์, M. A., อัคปา, P. A., อุกวู, K. C., เคเนชุควู, F. C., และเคนเน็ธ, O. C. (2020). เภสัชพลศาสตร์และพฤติกรรมทางเภสัชจลนศาสตร์ของอินซูลินจากอนุภาคจุลภาค PEGylated-Mucin เคลือบด้วยพอลิเมอร์ที่ไวต่อค่า pH: การเตรียมและการกําหนดลักษณะ. แม่. วันนี้คอมมูน. 25, 101539. ดอย:10.1016/เจ.เอ็มทีคอม.2020.101539
โมโมห์, M., อาเดโดคุน, M., อดิกวู, M., และ Ibezim, C. (2014). ในหลอดทดลอง การประเมิน PEGylated-Mucin Matrix เป็นตัวพาสําหรับการจัดส่ง Metformin Hydrochloride ในช่องปาก. ทรอป. J. ฟาร์ม. เรส. 13, 1039–1045. ดอย:10.4314/tjpr.v13i7.5
หมู่, A., โอโคลี, C. O., และ Agboke, A. (2008). ผลของเมือกหอยทากต่ออัตราการรักษาแผลของ Clarithromycin. J. ฟาร์ม. เรส. 8, 6. ดอย:10.18579/JPCRKC/2009/8/1/79523
มูมูนี, M. A., เคเนชุควู, F. C., โอโฟกันซี, K. C., อัตตามา, A. A., และดิอาซ, D. D. (2020). อนุภาคนาโน Mucoadhesive ที่บรรจุอินซูลินโดยใช้คอมเพล็กซ์เมือกไคโตซานสําหรับการจัดส่งทางปากและการรักษาโรคเบาหวาน. คาร์โบไฮเดรต. โพลีม. 229, 115506. ดอย:10.1016/เจ.คาร์บโพล.2019.115506
นาวาร์โร, L. A., ฝรั่งเศส, D. L., และ Zauscher, S. (2018). ความก้าวหน้าในการสังเคราะห์เลียนแบบเมือกและการประยุกต์ใช้ในวิทยาศาสตร์พื้นผิว. เคิร์ก. โอพิน. คอลลอยด์ Interf. วิทย์. 38, 122–134. ดอย:10.1016/เจ.โคซิส.2018.09.004
เหงียน, J. K., มาซับ, N., และ Jagdeo, J. (2020). สารออกฤทธิ์ทางชีวภาพในเวชสําอางเกาหลี: แนวโน้มและหลักฐานการวิจัย. J. คอสเมท. เดอร์มาทอล. 19, 1555–1569. ดอย:10.1111/jocd.13344
จอด, Y. (2011). การทําเหมืองแร่ผลิตภัณฑ์ธรรมชาติที่ไม่มีกระดูกสันหลังสําหรับสมบัติการรักษาในอนาคต. ณัฐ. แยง. ชุมชน. 6 (9), 1403–1408. ดอย:10.1177/1934578×1100600944
เปเรซ-วิลาร์, J., และเนินเขา, R. L. (1999). โครงสร้างและการประกอบเมือกที่หลั่งออกมา. J. ไบโอล. เคมี. 274, 31751–31754. ดอย:10.1074/เจบีซี.274.45.31751
เปโตร, G., และ Crouzier, T. (2018). เมือกเป็นส่วนประกอบอเนกประสงค์ของวัสดุชีวภาพ. ไบโอเมเตอร์. วิทย์. 6, 2282–2297. ดอย:10.1039/ค 8BM0047
พิตต์, S. J., เกรแฮม, M. A., เดดิ, C. G., เทย์เลอร์-แฮร์ริส, P. M., และกันน์, A. (2015). คุณสมบัติต้านจุลชีพของเมือกจากหอยทากสวนสีน้ําตาล Helix Aspersa. Br. J. ไบโอเมด. วิทย์. 72, 174–181. ดอย:10.1080/09674845.2015.11665749
พรีมี, S. (2020). บทบาทของเคมีเมลานินในการลุกลามของเมลาโนมาและการดื้อยา. หน้า. ออนคอล. 10. ดอย:10.3389/ฟอน.2020.01305
พุชพาส, ร.-ก. G., เปลลิกชอตตา, N., เคลลี่, C., ผู้คุมสอบ, G., และช่างไม้, G. H. (2019). การจับเมือกน้ําลายที่ลดลงและไกลโคซิเลชันในผู้สูงอายุมีอิทธิพลต่อรสชาติใน ในหลอดทดลอง แบบจําลองเซลล์. สารอาหาร 11, 2280. ดอย:10.3390/NU11102280
พุชพาส, R. G., ดาลี่, B., เคลลี่, C., ผู้คุมสอบ, G., และช่างไม้, G. H. (2019). การเปลี่ยนแปลงการไหลของน้ําลาย, องค์ประกอบของโปรตีน, และรีโอโลยีหลังการกระตุ้นรสชาติและ TRP ในผู้สูงอายุ. หน้า. ฟิสิออล. 10, 652. ดอย:10.3389/เอฟไฟส์.2019.00652
กุหลาบ, M. C., และ Voynow, J. A. (2006). ยีนเมือกทางเดินหายใจและเมือกไกลโคโปรตีนในสุขภาพและโรค. ฟิสิออล. รอบ. 86, 245–278. ดอย:10.1152/ฟิสเรฟ.00010.2005
รุทคอฟสกี้, P., และ Kozak, K. (2017). ข่าวจาก Melanoma Sessions ของ European Cancer Congress 2017. บีเอ็มซี เมด. 15, 57. ดอย:10.1186/ส 12916-017-0826-4
แซนด์เบิร์ก, T., คาร์ลสัน ออต, M., คาร์ลสัน, J., ไฟเลอร์, A., และคาลด์เวลล์, K. D. (2009). การใช้เมือกเป็นสารเคลือบวัสดุชีวภาพ. อิอิ. การเคลือบเมือกส่งผลต่อโครงสร้างและคุณสมบัติการกระตุ้นนิวโทรฟิลของโปรตีนโฮสต์ที่ดูดซับไปสู่การเลียนแบบเยื่อเมือก. J. ไบโอเมด. แม่. เรส. 91A, 773–785. ดอย:10.1002/เจบีเอ็ม.เอ.32315
ซานทาน่า, W. A., เมโล, C. M. d., คาร์โดโซ, J. C., เปเรร่า-ฟิลโญ่, R. N., ราเบโล, A. S., Reis, F. P., et al. (2012). การประเมินฤทธิ์ต้านจุลชีพและศักยภาพในการรักษาของการหลั่งเมือกของ Achatina fulica. Int. J. มอร์ฟอล. 30, 365–373. ดอย:10.4067/ส 0717-95022012000200001
สมเพยรัค, L. M. (2012). ระบบภูมิคุ้มกันทํางานอย่างไร. 4th อีดิโอ;.
แวน พัตเทน, J. P. M., และ Strijbis, K. (2017). เมือกเมมเบรน: ตัวรับสัญญาณที่จุดตัดของการอักเสบและมะเร็ง. J. Immun โดยกําเนิด. 9, 281–299. ดอย:10.1159/000453594
รถตู้, H., Hjorth, M., วินเคลยานน์, B., โดบริเดน, ผม, ลีเลก, O., และ Crouzier, T. (2020). การดัดแปลงไกลโคของเมือกไฮโดรเจลเพื่อตรวจสอบกิจกรรมภูมิคุ้มกันของพวกเขา. เอซีเอส แอพพลิเค. แม่. อินเตอร์. 12, 19324–19336. ดอย:10.1021/อัคซามี.0ค 03645
ผู้เขียน: แม็กซ์เวลล์ แมคเดอร์มอตต์, อันโตนิโอ อาร์. เซรุลโล, เจมส์ พาร์เซียล, เอลีโอโนรา อัครักษ์, ชาร์มิน สุลต่าน,เจนนิเฟอร์ เฟิร์ด, ซาฟียาห์ ซาหมัด, วิลเลียม เติ้ง, อดัมบี. บราวน์ชไว, แมนดู โฮลฟอร์ด.