Без рубрики
Chức năng và ứng dụng của Snail Mucins
Mucins là một họ protein glycosyl hóa cao được động vật tiết ra để bám dính, hydrat hóa, bôi trơn, và các chức năng khác. Bất chấp sự phổ biến của họ, chất nhầy động vật phần lớn không được đặc trưng. Ốc sên sản xuất protein nhầy trong chất nhầy của chúng cho một loạt các chức năng sinh học, bao gồm bảo vệ vi sinh vật, Độ bám dính và bôi trơn. Vừa mới, Chất nhầy của ốc sên cũng đã trở thành một nguồn đổi mới sinh lợi với các ứng dụng rộng rãi trong hóa học, sinh học, Công nghệ sinh học, và y sinh. Đặc biệt, Chất nhầy ốc sên đã được áp dụng làm sản phẩm chăm sóc da, chất chữa lành vết thương, keo phẫu thuật, và để chống loét dạ dày. Những tiến bộ gần đây trong omics tích hợp (Bộ gen, phiên âm, proteomic, glycomic) Công nghệ đã cải thiện đặc tính của chất nhầy dạ dày, tăng cường tạo ra vật liệu sinh học mới. Quan điểm này mô tả nghiên cứu hiện tại về chất nhầy ốc sên tiết ra, Làm nổi bật tiềm năng của polyme sinh học này, và cũng vạch ra một chiến lược nghiên cứu để đáp ứng nhu cầu chưa được đáp ứng trong việc kiểm tra các cấu trúc phân cấp dẫn đến sự đa dạng sinh học và hóa học to lớn của các gen nhầy của ốc sên.
Giới thiệu
Âm mưu trong những con đường mòn chất nhầy do ốc sên và sên để lại có từ thời Hy Lạp cổ đại, nơi họ sử dụng chất nhầy cho khả năng giảm viêm và các dấu hiệu lão hóa. Ngày nay, chất nhầy của ốc sên vẫn được sử dụng trong các sản phẩm chăm sóc da của nhiều công ty khác nhau và là một thị trường đang phát triển với giá trị dự kiến sẽ tiếp cận $770 triệu bởi 2025. Mặc dù ứng dụng thương mại của nó, Lĩnh vực nghiên cứu chất nhầy vẫn còn kém phát triển một cách đáng ngạc nhiên. Thành phần chính chịu trách nhiệm về tính chất của chất nhầy là chất nhầy tiết ra, Một họ protein glycosyl hóa nặng được sản xuất trong các tế bào biểu mô ở hầu hết các loài động vật. Chất nhầy được liên kết với màng plasma hoặc tiết ra khỏi tế bào, Và mỗi loại có sự khác biệt lớn về chức năng và khả năng của chúng. Chất nhầy liên kết màng là glycolipid hoạt động như các dấu hiệu cho tín hiệu tế bào và cũng bảo vệ tế bào khỏi sự sỉ nhục ngoại bào có thể dẫn đến tổn thương, chẳng hạn như nhiễm trùng và căng thẳng về thể chất . Chất nhầy tiết ra có thể là polyme sinh học tạo gel hoặc không tạo gel. Các polyme sinh học tiết ra tạo thành màng nhầy quy mô vĩ mô. Các màng niêm mạc này chiếm một phần lớn diện tích bề mặt của các sinh vật đa bào tiếp xúc với môi trường. Ở người, Màng niêm mạc chiếm 99% diện tích bề mặt cơ thể. Mỗi loài ốc tiết ra nhiều chất nhầy chức năng riêng biệt. Chất nhầy được sản xuất bởi chân ốc sên được sử dụng để bám dính và bôi trơn, cho phép ốc sên dính vào hoặc đi trên bất kỳ bề mặt nào, ngay cả khi đảo ngược. Ngoài ra, Chất nhầy được sản xuất trên lưng ốc sên được sử dụng để bảo vệ vi sinh vật và hydrat hóa mô. Một số loài ốc sên có công dụng chuyên biệt cho chất nhầy. Chẳng hạn, Falsilunatia eltanini (Ốc sên mặt trăng) Sử dụng chất nhầy để bảo vệ trứng của chúng, và Tikoconus costarricanus (Ốc đất Costa Rica), Sử dụng chất nhầy cho các hoạt động chịu tải, chẳng hạn như trốn tránh Mặt trời dưới đáy lá trong thời gian hạn hán. Những tiến bộ gần đây trong omics (Bộ gen, phiên âm, proteomic, glycomics) Công nghệ đã mở rộng việc khám phá chất nhầy dạ dày như một nguồn tài nguyên khoa học với các ứng dụng rộng rãi trên hóa học, sinh học, Công nghệ sinh học, và y học. Chẳng hạn, Các đặc tính kháng khuẩn của chất nhầy ốc sên đang được sử dụng để chống lại các rối loạn thường thấy ở người, từ loét dạ dày, đến nhiễm trùng sau phẫu thuật. Chất nhầy cũng đang được kết hợp với phương pháp điều trị đã được phê duyệt để tăng cường khả năng chữa bệnh của thuốc, chẳng hạn như bệnh tiểu đường và viêm loét đại tràng. Ngoài ra, Chất nhầy của ốc sên đang được nghiên cứu trong một loạt các ứng dụng công nghệ sinh học khác khai thác các đặc tính giống như chất hoạt động bề mặt của chúng . Mặc dù tiềm năng của họ, Người ta biết rất ít về cách các cấu trúc mucin phân cấp giải thích cho các tính chất chức năng đa dạng của chúng. Có một nhu cầu chưa được đáp ứng để kiểm tra sự đa dạng sinh học và hóa học của gen nhầy ốc sên để làm sáng tỏ các nguyên tắc hướng dẫn xác định các tính chất đa dạng liên quan đến từng gen. Bài viết phối cảnh này sẽ nêu bật các ứng dụng hiện tại của chất nhầy ốc tiết ra chứng minh tiềm năng của polyme sinh học này như một nguồn tài nguyên cho những tiến bộ công nghệ sinh học và y sinh. Chúng tôi cũng sẽ mô tả một chiến lược omics tích hợp để điều tra sự đa dạng sinh học và hóa học của gen nhầy ốc sên.
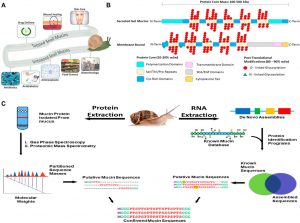
(Một) Ứng dụng của chất nhầy ốc sên. Chất nhầy của ốc sên đã được sử dụng để chăm sóc da, chữa lành vết thương và trẻ hóa, và giao thuốc. Chất nhầy của ốc sên đang được khám phá trong khoa học thực phẩm, Lớp phủ cấy ghép, và các ngành công nghệ sinh học khác hiện đang nghiên cứu chất nhầy để được khám phá để sử dụng tiềm năng. (B) Một đại diện 2 chiều của các cấu trúc mucin. Chất nhầy được đặc trưng bởi hai phần cấu trúc của chúng, lõi protein của họ, và phân nhánh glycan của chúng. Lõi protein là một chuỗi protein có chiều dài thay đổi tùy thuộc vào gen mucin, đã được sửa đổi thêm với các nhánh glycosyl hóa. Cấu trúc Protein, tuy nhiên có nhiều tên miền, Và các miền này khác nhau tùy thuộc vào chức năng và vị trí tế bào của chất nhầy. Các nhánh glycan là các nhánh đường khác nhau, từ 3 đến 18 Đường, và chiếm phần lớn khối lượng mucin. Hiển thị là 2 biểu diễn kích thước của các loại chất nhầy khác nhau, và các đặc điểm khuôn mẫu của họ. (C) Áp dụng phương pháp tiếp cận omics tích hợp để xác định trình tự chất nhầy của ốc sên, cấu trúc, và chức năng. Con đường 1(Bên trái) Chiết xuất protein mucin thô và tách ra khỏi các mảnh vụn tế bào để thu được khối lượng trình tự từ các phân tích quang phổ và khối phổ. Con đường 2(Bên phải) Chiết xuất RNA từ các tuyến nhầy hoặc toàn bộ động vật, tiếp theo là de novo lắp ráp các chuỗi gen mucin để tạo ra một cơ sở dữ liệu để BLAST chống lại bằng cách so sánh các trình tự lắp ráp với cơ sở dữ liệu mucin đã biết, Chúng tôi thu được trình tự mucin giả định. Kết hợp các đường ống proteomic và RNA, chúng tôi xác nhận trình tự mucin loại bản địa để phân tích thêm.
Biến thể cấu trúc của mucins
Mucins chứa một số tên miền đóng góp vào chức năng tổng thể của chúng. Sự biến đổi cấu trúc cho phép đa dạng sinh học rộng lớn và các đặc điểm vật lý độc đáo của chúng. Một miền lặp lại song song nằm ở trung tâm của xương sống protein, giàu serine, threonine, và proline, phục vụ như một mỏ neo cho glycosyl hóa. Mucin glycans chủ yếu liên kết O, nhưng một lượng nhỏ glycans liên kết N có thể có mặt. Độ dài của miền glycosyl hóa và số lần lặp lại khác nhau giữa các chất nhầy và truyền đạt các đặc tính hóa học khác nhau. Chất nhầy tiết ra có vùng giàu cysteine ở cả hai đầu của miền lặp lại song song được sử dụng để ổn định, Cung cấp các điểm cầu disulfide cho cả hai inter- và liên kết nội phân tử. Ngoài ra, Các khu vực này phục vụ cả hai để cung cấp đa dạng hóa cấu trúc bổ sung, và cho phép đa phân hóa chất nhầy và các phân tử sinh học giàu lưu huỳnh khác .
Thường, N-acetylgalactosamine (GalNAc) được gắn vào lõi protein thông qua liên kết O-glycosid giữa monosacarit và dư lượng Ser hoặc Thr (GalNAc[α1]-Ser / Thr). Điều này tạo thành kháng nguyên TN, thường được tìm thấy ở người để được điều hòa trong một số bệnh ung thư . Từ đó, Galactose được gắn vào cấu trúc (Gal[β1-3]GalNAc[α1]-Ser / Thr), hình thành lõi mucin 1 O-glycan. O-glycans khác nhau về kích thước, từ 2 đến 20 dư lượng đường, và trong thành phần, như các loại đường khác như N-acetylglucosamine (GlcNAc) và fucose (Phúc) được nối nối tuần tự. Axit sialic và mannose cũng được tìm thấy với số lượng dấu vết. Axit sialic nói riêng, đã được biết là đóng một vai trò quan trọng trong các đặc tính miễn dịch của chất nhầy. Axit sialic làm trung gian tương tác giữa tế bào với tế bào, cùng với khả năng che dấu kháng nguyên từ các đại thực bào ở người . Hơn nữa, Axit sialic là điểm liên kết chính đối với lectin, Một họ protein phổ biến được tìm thấy trong hệ thống miễn dịch bẩm sinh. Ngoài ra, Chất nhầy tiết ra cũng biểu hiện C-mannosyl hóa, trong đó C1 của mannose liên kết với vòng indole trong tryptophan, cho phép sự thay đổi lớn hơn của cấu trúc bậc ba .
Những thay đổi tinh tế trong cấu trúc mucin, đặc biệt là trình tự axit amin và glycosyl hóa;, có thể tương ứng với chức năng sinh học rất khác nhau . Trong khi các protein này chủ yếu là carbohydrate theo trọng lượng, lên đến 90%, Cả cấu trúc protein và glycan đều cung cấp các đặc tính chức năng tổng thể cho chất nhầy. Ngoài ra, Chất nhầy riêng lẻ có thể có nhiều glycoform ở trạng thái bình thường và bị bệnh, và các quần thể khác nhau của một loài duy nhất có thể biểu hiện glycoforms riêng biệt. Sự đa dạng này cho phép các sinh vật cá nhân hóa từng chất nhầy cho các điều kiện sinh lý và môi trường cụ thể. Nhìn chung, có rất ít thông tin về mối liên hệ kiểu gen với kiểu hình của các gen mucin dẫn đến các tính chất chức năng khác nhau. Một số gen mucin của con người đã được xác định và có ít nhất là 21 Các gen mã hóa mucin được xác nhận, mỗi hoạt động sinh học khác nhau. Ngược lại, Trong khi nhiều gen mucin giả định của ốc sên đã được xác định, không có gen nào được xác nhận. Tuy nhiên, Việc thiếu đặc tính mạnh mẽ về di truyền và sự khác biệt về cấu trúc giữa các chất nhầy của ốc sên đã không loại trừ ứng dụng của chúng để giải quyết nhu cầu vật liệu y tế và công nghệ sinh học cấp bách.
Chất nhầy ốc sên làm chất kháng khuẩn
Vi khuẩn kháng kháng sinh đang trở thành một vấn đề ngày càng phổ biến mà không có nhiều giải pháp khả thi. Bởi vì động vật thân mềm thiếu khả năng miễn dịch thích nghi, Chúng phụ thuộc vào các rào cản vật lý và khả năng miễn dịch bẩm sinh để bảo vệ chống lại các tác nhân gây bệnh. Đối với hầu hết các loài ốc, Bàn chân tiếp xúc nhiều nhất với các bề mặt bị nhiễm mầm bệnh và ký sinh trùng, và tiết chất nhầy dọc theo bàn chân bảo vệ chống lại các vi khuẩn như vậy. Một trong những chất nhầy sớm nhất được đánh giá về hoạt tính kháng khuẩn là Achatina Fulica (Ốc đất khổng lồ châu Phi). Chất nhầy từ Một. Fulica đã chứng minh hoạt tính kháng khuẩn đầy hứa hẹn chống lại vi khuẩn Gram dương, Bacillus subtilis và Staphylococcus aureus, và vi khuẩn Gram âm, Escherichia coli và Pseudomonas aeruginosa . Dịch nhầy của Một. Fulica ức chế sự phát triển của vi khuẩn của cả hai S. Aureus và S. biểu bì Khi áp dụng thông qua băng vết thương phim trên một mô hình chuột. Băng vết thương cải thiện sự trưởng thành của mô hạt và tốc độ lắng đọng collagen, được biết là đẩy nhanh quá trình chữa bệnh . Trong một nghiên cứu tương tự, chất nhầy của Helix aspersa đã chứng minh hoạt tính kháng khuẩn chống lại một số chủng Pseudomonas aeruginosa. Hơn nữa, chất nhầy của cả hai Một. Lề và Một. Fulica, đã được sử dụng làm băng vết thương trên 28 mẫu vết thương lâm sàng được thu thập với các bệnh nhiễm trùng thông thường đã biết. Chất nhầy cho thấy khả năng chống vi khuẩn chống lại Tụ cầu khuẩn, Liên cầu khuẩn, và Pseudomonas phân lập từ vết thương. Trong cùng một nghiên cứu, khi so sánh với bảy loại kháng sinh thông thường, bao gồm amoxicillin, Streptomycin, và chloramphenicol, Một số chất nhầy tiết ra nhiều ức chế nhiễm trùng hơn kháng sinh thương mại. Hiểu được đặc tính kháng khuẩn của chất nhầy ốc sên là một lĩnh vực nghiên cứu tích cực và đang phát triển.
Các loài động vật thân mềm có chất nhầy đã được áp dụng trong các lĩnh vực khác nhau cho các ứng dụng y sinh hoặc công nghệ sinh học. Chất nhầy nhuyễn thể được sử dụng làm chất kháng khuẩn để ức chế mầm bệnh.
Chất nhầy ốc sên làm phương tiện giao thuốc
Khả năng thích ứng của các polyme sinh học mucin ốc sên làm cho chúng trở thành ứng cử viên đầy hứa hẹn duy nhất cho các hệ thống phân phối thuốc mới. Trong quá trình giao phối, Ốc sên đực bắn phi tiêu để đưa chất nhầy chứa protein phụ vào con cái, từ đó làm tăng khả năng sinh sản của ốc cái . Quá trình này dựa trên một hệ thống đa chức năng, với mỗi thành phần đóng một vai trò xác định. Phi tiêu hoạt động như một cây kim, xuyên qua mô và tiêm chất nhầy mang protein phụ vào ốc cái. Theo cách tương tự, Chất nhầy có thể được điều chỉnh để hoạt động như một vectơ phân phối cho các phân tử hoạt tính sinh học. Chất nhầy của ốc sên được biết là kết hợp đặc biệt tốt với bất kỳ loại thuốc nào được hấp thụ qua màng nhầy vì khả năng tạo điều kiện khuếch tán qua màng . Chẳng hạn, metformin hydrochloride, một loại thuốc trị tiểu đường, được gắn vào mucin ốc đất châu Phi khổng lồ bằng polyethylene glycol (PEG) để tăng khả dụng sinh học của thuốc. PEGylation, là một quá trình thường được sử dụng trong đó một liệu pháp được bao quanh bởi một ma trận polyme chủ yếu, polyetylen glycol. Ma trận này thuận lợi ảnh hưởng đến dược động học của liệu pháp, kéo dài thời gian bán hủy, thông qua bảo vệ khỏi kháng thể, và cho phép kiểm soát thay đổi phân phối sinh học tùy thuộc vào thành phần ma trận. Chất nhầy ốc sên đặc biệt cho thấy hứa hẹn như một polymer, vì chúng rất ưa nước, và cũng dễ dàng tương tác với niêm mạc đường tiêu hóa, một vị trí hấp thu thuốc phổ biến. PEGylated-mucin nạp metformin cải thiện dược động học và dược lực học của thuốc thường kém hấp thu, tăng phát hành lên 92% so với 81% Hiện đang được sử dụng trên thị trường. Trong một ứng dụng khác, toàn bộ Costus afer (hoa huệ gừng) Hoa kết hợp với chất nhầy của ốc sên cho thấy giảm lượng đường trong máu ở bệnh nhân tiểu đường Mus musculus (Chuột bạch tạng Thụy Sĩ) theo kiểu phụ thuộc vào liều, cho thấy tiềm năng chống tiểu đường có thể có của chất nhầy ốc sên.
Ma trận polymer liên kết thuốc và tinh thể vaterite chứa mucin đã được sử dụng làm chất mang thuốc để nạp hiệu quả và giải phóng có kiểm soát các loại thuốc chống ung thư nhỏ và liệu pháp dựa trên protein. Vi tinh thể Vaterite, khi kết tinh ở nồng độ mucin khác nhau: 1 và 6 mg/ml, duy trì tốt hơn các hoạt tính sinh học cation và ổn định trong điều kiện sinh lý Ngoài ra, Chất nhầy đã được kết hợp với chất nhạy sáng để tăng cường nhắm mục tiêu và tối ưu hóa việc kiểm soát việc đưa vào các tế bào ung thư. Viên nang đa lớp mucin tự lắp ráp và vi hạt chứa mucin được quan tâm đặc biệt cho các nghiên cứu trong tương lai về cơ chế phân phối thuốc giải phóng có kiểm soát, đặc biệt là để vượt qua những thách thức về tương thích sinh học, khả năng phân hủy sinh học, và chất nhầy bám dính.
Chất nhầy ốc sên làm chất chống khối u
Chất nhầy của ốc sên đã cho thấy tiềm năng điều trị chống lại khối u ác tính, Một trong những bệnh ung thư da nguy hiểm nhất. Trong khi những phát triển mới trong điều trị ung thư đã dẫn đến tỷ lệ thuyên giảm cao hơn và tuổi thọ dài hơn cho những người bị ảnh hưởng, Những phát triển này đã không cho thấy năng suất tương tự đối với khối u ác tính. Vì kháng điều trị là phổ biến đối với bệnh ung thư này, Có một nhu cầu cấp thiết để tìm ra các phương pháp mới hiệu quả để điều trị khối u ác tính. Một nghiên cứu về H. Apersa Chất nhầy trên các dòng tế bào u ác tính báo cáo rằng chất nhầy của ốc sên làm giảm khả năng tồn tại và ức chế sự di căn của các tế bào u ác tính. Sự giảm khả năng tồn tại của các tế bào được quy cho một sự kiện apoptotic liên quan đến sự phân cắt của Poly (ADP-ribose) polymerase (PARP). Ngoài ra, sự ức chế di căn đã đạt được bằng cách ngăn chặn chức năng và biểu hiện integrin, và do đó ức chế ung thư có thể phát triển. Trong một nghiên cứu khác, H. Aspersa Mucin trực tiếp ức chế sự phát triển của hai dòng tế bào u ác tính ở người, bằng cách tăng biểu hiện của cytokine TNFα, và ức chế NF-κB, Một quá trình phiên mã mà trong quy định thích hợp có liên quan đến sự tiến triển của ung thư, sự tăng trưởng của các dòng tế bào này đã giảm, thể hiện đặc tính chống melanogenic của nó. Trong khi vẫn còn trong giai đoạn phát triển ban đầu, Việc áp dụng chất nhầy ốc sên làm chất chống khối u đang được quan tâm ngày càng tăng trong cộng đồng y sinh.
Chất nhầy ốc sên tạo điều kiện chữa lành vết thương
Chất nhầy của ốc sên có thể tạo điều kiện chữa lành và đã trở thành một nguồn tài nguyên quan trọng trong nghiên cứu vết thương. Mucins từ Helix aspersa (Ốc sên vườn) đã được chứng minh là giúp tái tạo da sau viêm da phóng xạ cấp tính, Một tác dụng phụ thường gặp từ xạ trị. Chất nhầy của ốc sên trong vườn được báo cáo làm tăng tỷ lệ chữa lành thông qua chất chống oxy hóa và điều hòa gốc tự do. Chất nhầy từ vườn cải thiện ban đỏ trong mô hình chuột, và, Những con chuột tương tự cũng cho thấy giảm photoaging. Cũng như có thể điều trị chấn thương bề ngoài, Chất nhầy đã cho thấy khả năng được sử dụng trên vết thương bên trong. Chất nhầy đã được kết hợp cùng với thuốc chống viêm không steroid đường uống (NSAID), để giảm hoặc loại bỏ tổn thương niêm mạc dạ dày. NSAID làm giảm viêm, nhưng có tác dụng phụ bất lợi liên quan đến tổn thương đường tiêu hóa và tổn thương gan. Nhiều công ty đã chuyển sang các sản phẩm tự nhiên để chống lại các tác dụng phụ này, và Mucin đã được chứng minh là điều trị loét dạ dày tá tràng, một tác dụng phụ gây ra bởi NSAID. Sự kết hợp của kháng sinh, clarithromycin, và Một. Fulica Mucin đã cho thấy kết quả tích cực trong điều trị bệnh loét dạ dày tá tràng. Ngoài đặc tính chống loét, Tốc độ chữa lành vết loét tăng lên khi nồng độ chất nhầy và nhanh hơn clarithromycin đơn thuần.
Chất nhầy của ốc sên được sử dụng cho các vật liệu lấy cảm hứng từ sinh học
Nghiên cứu các chất tự nhiên như một nền tảng để xây dựng vật liệu mới đã dẫn đến nhiều sản phẩm mang tính cách mạng, chẳng hạn như Lipitor, Penicillin, và Morphine. Tương tự, Chất nhầy đã được sử dụng như một lớp phủ vật liệu sinh học để giảm sự từ chối cấy ghép vô cơ. Từ chối cấy ghép phẫu thuật do nhiễm trùng dẫn đến hơn 1 triệu trường hợp y tế mỗi năm với chi phí phẫu thuật ban đầu chỉ bằng một phần nhỏ chi phí điều trị nhiễm trùng tương ứng. Áp dụng màng dựa trên mucin cho polyetylen terephthalate, Một vật liệu phổ biến được sử dụng trong cấy ghép y tế, làm giảm đáng kể phản ứng miễn dịch được kích hoạt bởi sự hấp thụ IgG và IgM vào nhựa. Nghiên cứu tương tự cũng cho thấy nó làm giảm sự kích hoạt của fibrinogen, một tác nhân gây viêm đã biết, khi tiếp xúc với lớp phủ mucin so với nhựa không tráng. Chất nhầy đã được chứng minh trong các nghiên cứu khác để giảm sự sinh sản của vi khuẩn trên các thiết bị cấy ghép. Các công nghệ dựa trên Mucin cho thấy hứa hẹn to lớn cho những tiến bộ trong lĩnh vực vật liệu sinh học.
Một ví dụ về chất nhầy được sử dụng làm vật liệu sinh học là ứng dụng chất nhầy trong quá trình tổng hợp hydrocarbon tan trong nước. Bằng cách thắt các hợp chất bắt chước chất nhầy và / hoặc mucin bằng chuỗi lipid kỵ nước, Phức hợp hydrocarbon vẫn lơ lửng trong điều kiện nước, thậm chí sau vài tháng, trong khi hydrocarbon không phức tạp sẽ kết tủa nhanh chóng từ dung dịch. Trong một nghiên cứu liên quan khác được thực hiện bởi nhóm của Combaa, Tính chất này đã được áp dụng để tăng cường phát hiện glucose bằng cách tạo ra một huyền phù ổn định của phức hợp ống nano-mucin carbon cho cảm biến sinh học glucose loại bánh sandwich. Thiết bị phân tích sinh học kết quả là 20% nhạy cảm hơn và 40% Nhanh hơn các thiết bị thông thường không bao gồm ma trận thiết kế cảm biến này.
Chất nhầy, tiếp xúc với thuốc hấp thụ qua màng niêm mạc, cũng có thể được sử dụng trong sắc ký để hỗ trợ xác định sinh khả dụng và hấp thụ qua màng. Chất nhầy dạ dày lợn, liên kết với cột silica thông qua các liên kết propyl amin, được phép tách các phân tử thuốc bằng ái lực liên kết màng nhầy của thuốc. Trong một nghiên cứu khác, mucin được neo vào một cột bằng cách sử dụng trao đổi ion với canxi-alginate, chất nhầy bất động, Bắt chước màng nhầy sinh học. Thời gian lưu giữ lâu hơn của phân tử trong cột mucin cho thấy tương tác thuốc-mucin cao, Điều này tương quan với sinh khả dụng bị trì hoãn in vivo. Điều này bổ sung một khía cạnh khác để đánh giá các loại thuốc được sử dụng trong các bệnh cụ thể ảnh hưởng đến sản xuất chất nhầy, chẳng hạn như xơ nang.
Cột chất nhầy dạ dày lợn tương tự đã được sử dụng để đánh giá khả năng duy trì hương vị của ngành công nghiệp thực phẩm. Cột mucin đã được chứng minh là bắt chước lưỡi bò để giữ hương vị, làm giảm nhu cầu và có khả năng loại bỏ thử nghiệm trên động vật. Chất nhầy đã được nghiên cứu rộng rãi trong vai trò của chúng với nhận thức hương vị. Sự hiện diện của chất nhầy trong khoang miệng có tương quan trực tiếp với sự lắng đọng của các hợp chất tạo hương vị, từ đó làm tăng nhận thức hương vị. Hiện tượng này cũng đang được xem xét là nguyên nhân gây mất vị giác ở tuổi già. Giảm nồng độ MUC7 trong nước bọt đã được ghi nhận ở những người lớn tuổi giảm vị giác. Sự điều hòa này được cho là làm giảm sự kết dính chất nhầy của các phân tử hương vị, dẫn đến nhận thức vị giác suy giảm.
Tốc độ của ốc sên để mô tả các phân tử mucin
Mặc dù sự quan tâm ngày càng tăng trong lĩnh vực này, Vẫn còn nhiều trở ngại ngăn cản những tiến bộ trong nghiên cứu chất nhầy ốc sên. Nhiều loài ốc sên có tiềm năng khám phá chất nhầy mới thường không thể tiếp cận được vì môi trường sống của chúng. Việc thiếu các mẫu vật liệu sinh học dễ tiếp cận và khó khăn trong việc xác định cấu trúc mucin ngăn cản sự tổng hợp đáng tin cậy của chất nhầy với số lượng đủ để thử nghiệm lặp đi lặp lại. Một số nhóm đang nghiên cứu tính bền vững, Phương pháp tiếp cận có thể mở rộng để sản xuất chất nhầy tổng hợp, tuy nhiên, lĩnh vực này đang ở giai đoạn sơ khai Trong khi các chất nhầy đã được phân lập từ Một. Fulica đã được nghiên cứu rộng rãi, Các loài khác vẫn bị bỏ quên.
Phương pháp khả thi nhất để sản xuất chất nhầy thương mại vẫn là khai thác và cách ly từ động vật, không cho phép sản lượng đáng kể để áp dụng mà không có vốn động vật dồi dào và thường liên quan đến các phương pháp xâm lấn. Sự phức tạp, phong phú, và nội địa hóa các mẫu glycosyl hóa trên mỗi chất nhầy, Ngoài các glycoforms mucin khác nhau gây khó khăn trong việc sử dụng các phương pháp tách phổ biến để thanh lọc, tổng hợp, và phân tích mẫu mucin. Mucins thường trải qua sửa đổi sau dịch mã, chẳng hạn như O-sunfat hóa, N-sunfat hóa, và N-deacetyl hóa phân biệt chức năng giữa các protein. Những sửa đổi glycan sau dịch mã này là một trở ngại cho việc tinh chế mẫu mucin, Đặc tính, và tổng hợp. Một cách tiếp cận tổng hợp đầy hứa hẹn liên quan đến việc sử dụng vi khuẩn tái tổ hợp, glycosyltransferase(GT)-trùng hợp qua trung gian, và trans-glycosyl hóa. Tuy nhiên, Những phương pháp này không đủ để đạt được năng suất thực tế về mặt công nghiệp và sẽ không tạo ra bộ glycoform đầy đủ bao gồm gel nhầy tự nhiên. Vẫn còn khó khăn trong việc tạo ra chữ O–glycosyl hóa trong nấm men, Và có những thách thức liên quan đến việc chuyển các nhánh glycosyl hóa sang dư lượng protein được chọn. Những vấn đề này cho thấy nhu cầu phát triển các phương pháp khả thi và năng suất cao để tổng hợp chất nhầy bằng cách sử dụng các hóa chất có thể mở rộng, đây sẽ là bước đầu tiên trong việc sử dụng chất nhầy làm liệu pháp hoặc phương pháp điều trị nhắm mục tiêu.
Những năm gần đây đã chứng kiến sự xuất hiện của các công nghệ -omic (Bộ gen, Phiên âm, Proteomics, glycomics) yêu cầu số lượng mẫu tối thiểu, cho phép mô tả đặc tính của các mẫu ốc quý hiếm hoặc khó tiếp cận. Một chiến lược tương tự như những gì đã được thực hiện với nọc độc ốc sên bằng nọc độc, trong đó kết hợp các phương pháp phiên mã và proteomic với de novo Trình tự các chương trình lắp ráp tin sinh học để xác định cấu trúc di truyền của độc tố peptide giả định nọc độc ốc sên, có thể được áp dụng để mô tả gen mucin và protein nhầy. Đặc biệt, bằng cách lấy các chuỗi nucleotide của các exome lắp ráp, và sau đó ghép nối nó với các giá trị khối lượng protein, Chúng ta có thể xác nhận cấu trúc protein mucin tuyến tính. Trong phương pháp này, chúng tôi trích xuất mRNA từ các tuyến nhầy hoặc toàn bộ động vật và thông qua một đường ống thông tin sinh học, Xác định gen mucin và trình tự protein mucin chính. Một sáng kiến mới, Dự án Mucomics động vật so sánh (TRẠI) sẽ áp dụng một phân tích so sánh có hệ thống các gen mucin và hydrogel nhầy để xác định cấu trúc phân cấp và tính chất của các chất nhầy riêng biệt.
Mặc dù hứa hẹn các phương pháp omic để tạo ra cơ sở dữ liệu mạnh mẽ về chất nhầy, Những rào cản lớn vẫn còn cho nghiên cứu của họ. Một trở ngại như vậy là các thuật toán được sử dụng để lắp ráp các gen được giải trình tự. Đồ thị De Bruijn, đó là trình tự thuật toán mà hầu hết các nhà lắp ráp sử dụng, Gặp khó khăn trong việc ánh xạ các miền lặp lại do sự đa dạng của các chuỗi chồng chéo tương tự. Nhiều công cụ hiện đang được phát triển để khắc phục vấn đề này . Mỗi chương trình thay đổi trọng số của các k-mer được sử dụng để xây dựng đồ thị De Bruijn để phù hợp với các lần lặp song song. Đối với nghiên cứu proteomic mucin, Các tương tác liên phân tử của chất nhầy với các chất nhầy khác gây ra một mức độ khó khăn bổ sung. Mucins tự nhiên sẽ tạo ra multimers của chính họ, Kết nối nhiều protein với nhau để tạo thành một cấu trúc lớn hơn, thường xuyên được quan sát trong tự nhiên. Để sau đó có được một protein duy nhất, Các liên kết liên kết phải được phá vỡ, mà không phá vỡ các liên kết của protein đơn. Tuy nhiên, Liên kết mucin multimer rất khó giảm mà không có ảnh hưởng đến phần còn lại của cấu trúc thứ cấp của chuỗi mucin. Một quy trình thử và sai hiện đang được sử dụng trong các nghiên cứu proteomic mucin để tạo ra khối lượng protein đơn lẻ. Các kỹ thuật tổng hợp và mô tả đặc tính mới sẽ cần được thiết lập để xác định và chế tạo chính xác chất nhầy của ốc sên, Và với cách tiếp cận omics, chúng tôi có thể xác định kiểu gen để lập bản đồ kiểu hình cần thiết để hiểu và giải mã sự khác biệt về chức năng được tìm thấy trong mỗi mẫu mucin.
Phát biểu kết luận và quan điểm tương lai
Ốc sên được tìm thấy trong gần như mọi quần xã sinh vật, Và điều kiện môi trường dường như thúc đẩy sự đa dạng của gen mucin và tính linh hoạt của các chức năng chất nhầy. Chất nhầy của ốc sên đã chứng minh tiềm năng y sinh và công nghệ sinh học, và là một nguồn tài nguyên sinh học đầy hứa hẹn. Đặc tính của chất nhầy ốc sên bị giới hạn không phải bởi giá trị vốn có của chúng, nhưng bằng cách truy cập và sự phức tạp của việc nhận dạng phân tử, Thanh lọc và điều tra. Vẫn còn một số câu hỏi cần được trả lời về tính chất của chất nhầy và chất nhầy liên quan đến việc sử dụng áp dụng. Triển vọng này cho thấy tiềm năng năng suất cao của chất nhầy ốc sên, và bằng cách sử dụng một đường ống omics so sánh thích ứng, Chúng ta có thể hiểu rõ hơn về những protein độc đáo này, và tính chất sinh học và hóa học thuận lợi của chúng.
Tham khảo: Abdulla, Một., Adams, N., Xương, M., Elliott, Một. M., Gaffin, J., Jones, D., et al. (2013). Hướng dẫn kiểm soát cơn đau ở người cao tuổi. Tuổi tác lão hóa 42, I1–I57. Doi:10.1093/Lão hóa/AFS200
Abdullah, L. H., Coakley, R., Webster, M. J., Chu, Y., Tarran, R., Radicioni, G., et al. (2018). Sản xuất chất nhầy và phản ứng hydrat hóa với các vật liệu nhầy trong biểu mô đường thở bình thường so với xơ nang. Sáng. J. Hô hấp. Crit. Chăm sóc Med. 197, 481–491. Doi:10.1164/RCCM.201706-1139OC
Guchi, S. M. M., Aikawa, T., và Matsumoto, J. J. (1982). Hoạt tính kháng khuẩn của chất nhầy ốc sên. Comp. Biochem. Physiol. Một: Physiol. 72, 571–574. Doi:10.1016/0300-9629(82)90123-2
Lodi, M., Thái Khẩu, Một., Janssen, R., và Koene, J. M. (2017). Mức độ cạnh tranh tinh trùng cao có thể làm tăng sự chuyển giao các sản phẩm tuyến phụ kiện được mang theo bởi phi tiêu tình yêu của ốc đất. Sinh thái. Evol. 7, 11148–11156. Doi:10.1002/ECE3.3385
Mẹ, J., Rubin, B. K., và Voynow, J. Một. (2018). Chất nhầy, Nước nhầy, và Tế bào cốc. Ngực 154, 169–176. Doi:10.1016/j.ngực.2017.11.008
Martins, M. D. F., Caetano, F. Một. M., Sírio, O. J., Yiomasa, M. M., Mizusaki, C. Tôi., và Figueiredo, L. D. (2003). Avaliação macro e microscópica da cicatrização de lesões experimentalmente provocadas em pele de coelhos tratadas com secreção mucoglicoproteica Do escargot Achatina Fulica. Braz. J. Vet. Res. Anim. Sci. 40, 213. Doi:10.1590/s1413-95962003000900009
Một. Michael (Editor) (2012). “Multifarious Potentials of Tropical Animal-Derived Biopolymers in Drug Delivery: Lessons from the African Snail Mucin," Biopolymers in Drug Delivery: Recent Advances and Challenges (Sharjah, UAE: BENTHAM SCIENCE PUBLISHERS), 27–38. Doi:10.2174/978160805078910901010027
Mikheenko, Một., Bzikadze, Một. V., Gurevich, Một., Miga, K. H., and Pevzner, P. Một. (2020). TandemTools: Mapping Long Reads and Assessing/improving Assembly Quality in Extra-long Tandem Repeats. Mar. Drugs 17, i75–i83. Doi:10.1093/bioinformatics/btaa440
Momoh, M. Một., Akpa, P. Một., Ugwu, K. C., Kenechukwu, F. C., and Kenneth, O. C. (2020). Pharmacodynamics and Pharmacokinetics Behaviour of Insulin from PEGylated-Mucin Microparticles Coated with pH Sensitive Polymer: Preparation and Characterization. Mater. Today Commun. 25, 101539. Doi:10.1016/j.mtcomm.2020.101539
Momoh, M., Adedokun, M., Adikwu, M., and Ibezim, C. (2014). In Vitro evaluation of PEGylated-Mucin Matrix as Carrier for Oral Delivery of Metformin Hydrochloride. Trop. J. Pharm. Res. 13, 1039–1045. Doi:10.4314/tjpr.v13i7.5
Mu, Một., Okolie, C. O., and Agboke, Một. (2008). The Effect of Snail Mucin on the Ulcer Healing Rate of Clarithromycin. J. Pharm. Res. 8, 6. Doi:10.18579/jpcrkc/2009/8/1/79523
Mumuni, M. Một., Kenechukwu, F. C., Ofokansi, K. C., Attama, Một. Một., and Díaz, D. D. (2020). Insulin-loaded Mucoadhesive Nanoparticles Based on Mucin-Chitosan Complexes for Oral Delivery and Diabetes Treatment. Carbohydr. Polym. 229, 115506. Doi:10.1016/j.carbpol.2019.115506
Navarro, L. Một., French, D. L., and Zauscher, S. (2018). Advances in Mucin Mimic Synthesis and Applications in Surface Science. Curr. Opin. Colloid Interf. Sci. 38, 122–134. Doi:10.1016/j.cocis.2018.09.004
Nguyen, J. K., Masub, N., and Jagdeo, J. (2020). Bioactive Ingredients in Korean Cosmeceuticals: Trends and Research Evidence. J. Cosmet. Da liễu. 19, 1555–1569. Doi:10.1111/jocd.13344
Park, Y. (2011). Mining Invertebrate Natural Products for Future Therapeutic Treasure. Nat. Prod. Commun. 6 (9), 1403–1408. Doi:10.1177/1934578×1100600944
Perez-Vilar, J., and Hill, R. L. (1999). The Structure and Assembly of Secreted Mucins. J. Biol. Chem. 274, 31751–31754. Doi:10.1074/jbc.274.45.31751
Petrou, G., and Crouzier, T. (2018). Mucins as Multifunctional Building Blocks of Biomaterials. Biomater. Sci. 6, 2282–2297. Doi:10.1039/c8bm0047
Pitt, S. J., Graham, M. Một., Dedi, C. G., Taylor-Harris, P. M., and Gunn, Một. (2015). Antimicrobial Properties of Mucus from the Brown Garden Snail Helix Aspersa. Br. J. Biomed. Sci. 72, 174–181. Doi:10.1080/09674845.2015.11665749
Premi, S. (2020). Role of Melanin Chemiexcitation in Melanoma Progression and Drug Resistance. Front. Oncol. 10. Doi:10.3389/fonc.2020.01305
Pushpass, R.-A. G., Pellicciotta, N., Kelly, C., Proctor, G., and Carpenter, G. H. (2019). Reduced Salivary Mucin Binding and Glycosylation in Older Adults Influences Taste in an In Vitro Cell Model. Nutrients 11, 2280. Doi:10.3390/nu11102280
Pushpass, R. G., Daly, B., Kelly, C., Proctor, G., and Carpenter, G. H. (2019). Altered Salivary Flow, Protein Composition, and Rheology Following Taste and TRP Stimulation in Older Adults. Front. Physiol. 10, 652. Doi:10.3389/fphys.2019.00652
Rose, M. C., và Voynow, J. Một. (2006). Respiratory Tract Mucin Genes and Mucin Glycoproteins in Health and Disease. Physiol. Rev. 86, 245–278. Doi:10.1152/physrev.00010.2005
Rutkowski, P., and Kozak, K. (2017). News from the Melanoma Sessions of the European Cancer Congress 2017. BMC Med. 15, 57. Doi:10.1186/s12916-017-0826-4
Sandberg, T., Karlsson Ott, M., Carlsson, J., Feiler, Một., and Caldwell, K. D. (2009). Potential Use of Mucins as Biomaterial Coatings. II. Mucin Coatings Affect the Conformation and Neutrophil-Activating Properties of Adsorbed Host Proteins-Toward a Mucosal Mimic. J. Biomed. Mater. Res. 91Một, 773–785. Doi:10.1002/jbm.a.32315
Santana, W. Một., Melo, C. M. d., Cardoso, J. C., Pereira-Filho, R. N., Rabelo, Một. S., Reis, F. P., et al. (2012). Assessment of Antimicrobial Activity and Healing Potential of Mucous Secretion of Achatina Fulica. Int. J. Morphol. 30, 365–373. Doi:10.4067/s0717-95022012000200001
Sompayrac, L. M. (2012). How the Immune System Works. 4th Editio.
Van Putten, J. P. M., and Strijbis, K. (2017). Transmembrane Mucins: Signaling Receptors at the Intersection of Inflammation and Cancer. J. Innate Immun. 9, 281–299. Doi:10.1159/000453594
Van, H., Hjorth, M., Winkeljann, B., Dobryden, Tôi., Lieleg, O., and Crouzier, T. (2020). Glyco-Modification of Mucin Hydrogels to Investigate Their Immune Activity. ACS Appl. Mater. Inter. 12, 19324–19336. Doi:10.1021/acsami.0c03645
The authors: Maxwell McDermott, Antonio R. Cerullo, James Parziale, Eleonora Achrak, Sharmin Sultana,Jennifer Ferd, Safiyah Samad, William Deng, Adam B. Braunschweig, Mandë Holford.